Wenn Wachstum zum Schwachpunkt wird
In Kürze
- Wachsen Zellen in Zellkulturen während einer Behandlung mit teilungsunterdrückenden Wirkstoffen, wachsen sie übermässig und verlieren dauerhaft ihre Teilungsfähigkeit.
- Werden die Zellen jedoch mit einer Kombination von Teilungshemmern und Wachstumshemmern behandelt, bleiben sie nach dem Absetzen der Substanzen teilungsfähig.
- Die Erkenntnisse könnten auf gewisse Krebstherapien übertragen werden, müssen aber erst klinisch überprüft und bestätigt werden.
Wachstum ist ein grundlegender biologischer Prozess und Voraussetzung dafür, dass sich Lebewesen vermehren und entwickeln können. Das Zellwachstum, also die Produktion von neuer Biomasse, und die Zellteilung müssen dazu miteinander abgestimmt sein.
In vielzelligen Organismen wie einem Menschen muss das Wachstum der Zellen zudem mit ihrer Umgebung koordiniert werden, damit Zellen in der richtigen Anzahl und Grösse vorliegen, um ein funktionales Gewebe oder Organ zu bilden. Zellwachstum ist darum strikte reguliert und findet nur dann statt, wenn die richtigen Wachstumssignale vorhanden sind.
Anders bei Krebszellen. Bei ihnen ist das Wachstum ausser Kontrolle geraten, sie teilen sich unablässig und reagieren auch nicht auf Stoppsignale aus ihrer Umgebung.
Vorteil kann ein Nachteil sein
Nun zeigen mehrere in der Fachzeitschrift «Molecular Cell» erschienene Studien auf, dass das unkontrollierte Wachstum für die Krebszellen nicht nur ein Vorteil, sondern auch eine Schwachstelle ist.
Eine dieser Studien entstand unter der Leitung von Professor Gabriel Neurohr vom Institut für Biochemie der ETH Zürich. Seit einigen Jahren erforschen er und seine Gruppe, wie das Zellwachstum die Funktion von Zellen beeinflusst. Zudem untersuchen sie, was geschieht, wenn Zellen ihre normale Grösse überschreiten und in einen Zustand übergehen, den die Forschenden als Seneszenz bezeichnen. In diesem Zustand sind die Zellen übernatürlich gross und verlieren die Fähigkeit sich zu teilen. Trotzdem sind sie noch aktiv und beeinflussen ihre Umgebung, etwa indem sie Botenstoffe ausschütten.
Seneszente Zellen kommen in normalem Gewebe vor und spielen eine wichtige Rolle beim Alterungsprozess. Die Seneszenz kann aber auch mit chemischen Substanzen eingeleitet werden, und weil sie zu einem Verlust der Teilfähigkeit führt, ist Seneszenz das Ziel gewisser Krebstherapien.
DNA-Reparatur funktioniert nicht mehr
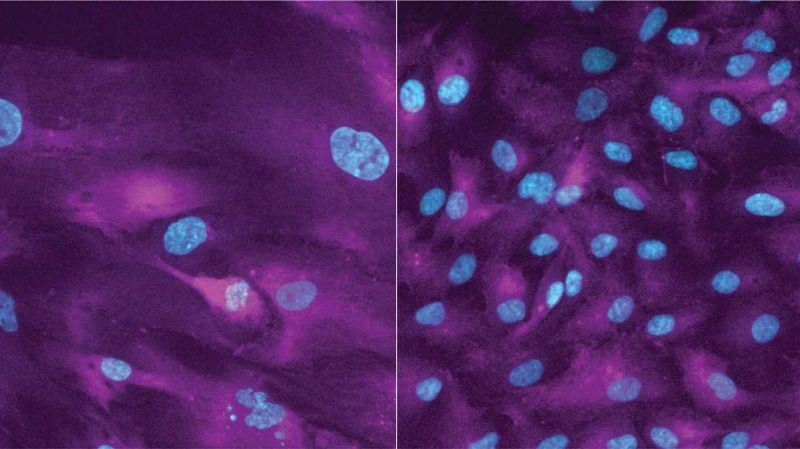
Neurohrs Mitarbeiterin Sandhya Manohar hat nun untersucht, ob das Überschreiten der normalen Grösse die zellulären Funktionen in seneszenten Zellen beeinflusst. Die Forscherin hat deshalb eine nicht-krebsartige Zelllinie und eine Brustkrebs-Zelllinie mit Substanzen behandelt, die das Wachstum und die Teilung hemmen.
Setzte die Forscherin in ihren Zellkulturen nur teilungsunterdrückende Substanzen ein, konnten sich die Zellen tatsächlich nicht mehr teilen, wuchsen aber weiter und gingen in die Seneszenz. Dadurch verloren sie ihre Teilungsfähigkeit dauerhaft. Dieser Effekt hielt auch an, nachdem die Forscherin die Teilungs-Hemmer abgesetzt hatte.
Ein wichtiger Grund für den Verlust der Teilungsfähigkeit ist, dass die übergrossen Zellen Schäden an ihrem Erbgut, wie beispielsweise den Bruch von DNA-Doppelsträngen, nicht mehr reparieren können. Solche Schäden entstehen immer wieder spontan, wenn eine Zelle ihr Erbmaterial vor einer Zellteilung verdoppelt.
Ausserdem können diese Zellen einen wichtigen Signalweg (p53-p21), der für eine koordinierte Reaktion auf DNA-Schäden wichtig wäre, nicht korrekt aktivieren. Dies führt dazu, dass DNA-Schäden nicht effizient genug repariert werden. In übergrossen Zellen häufen sich deshalb während der Teilung zahlreiche irreparable DNA-Schäden – bis die Teilung nicht mehr möglich ist.
Ist die Kombinationstherapie kontraproduktiv?
Behandelten die Forschenden die die Zellen aber gleichzeitig mit teilungshemmenden und wachstumshemmenden Substanzen, konnten sich die Zellen nach dem Absetzen beider Substanzen wieder normal teilen und vermehren. «Damit ist genau das passiert, was bei einer Krebsbehandlung nicht erwünscht ist», sagt Neurohr.
Wachstums- und teilungshemmende Wirkstoffe werden schon heute in der Krebstherapie eingesetzt. «Aufgrund unserer Beobachtungen in der Zellkultur würden wir bei der gleichzeitigen Behandlung eines Tumors mit Teilungs-Inhibitoren und mit Wachstums-Inhibitoren eine erhöhte Rückfallquote erwarten. Sinnvoller wäre es, erst einen Teilungs-Inhibitor einzusetzen, dann ein Medikament, das die DNA der Zellen weiter schädigt und die Teilung ganz verunmöglicht», sagt Neurohr.
Klinische Tests müssen Befund bestätigen
Ihre neuen Erkenntnisse haben die ETH-Forschenden jedoch erst an Zellkulturen getestet. Da Wachstum und Teilung stark von der Zellumgebung abhängen, können sie diese Ergebnisse nicht direkt in die Klinik übertragen. Es braucht daher erst Versuche mit Organoiden oder an Gewebeproben, um die Therapiemöglichkeit besser zu testen. Klinische Studien, die unterschiedliche Kombinationen von Teilungs-Inhibitoren und anderen Medikamenten untersuchen, sind zudem am Laufen.
Die Idee der ETH-Forschenden um Neurohr wird durch Studien von drei weiteren internationalen Forscherteams gestützt, die in derselben Ausgabe von «Molecular Cell» veröffentlicht wurden.
Diese Studien weisen nach, dass Krebszellen mit hyperaktivem Wachstum empfindlich auf die Behandlung mit Teilungs-Inhibitoren reagieren. Da bereits heute diese Substanzen unter anderem bei bestimmten Brustkrebsarten eingesetzt werden, könnten sich die neuen Erkenntnisse langfristig auf die Krebstherapie auswirken.