Wie die menschliche Mikrobiota dem Cholera-Bakterium widersteht
Die Cholera ist immer noch ein grosses Problem. Sieben grosse Pandemien hat es von dieser akuten Durchfallerkrankung in den letzten zweihundert Jahren gegeben. Nach Angaben der WHO fordert die Cholera noch immer jedes Jahr bis zu 143 000 Todesopfer und infiziert bis zu 4 Millionen Menschen, vor allem in armen oder unterentwickelten Ländern.
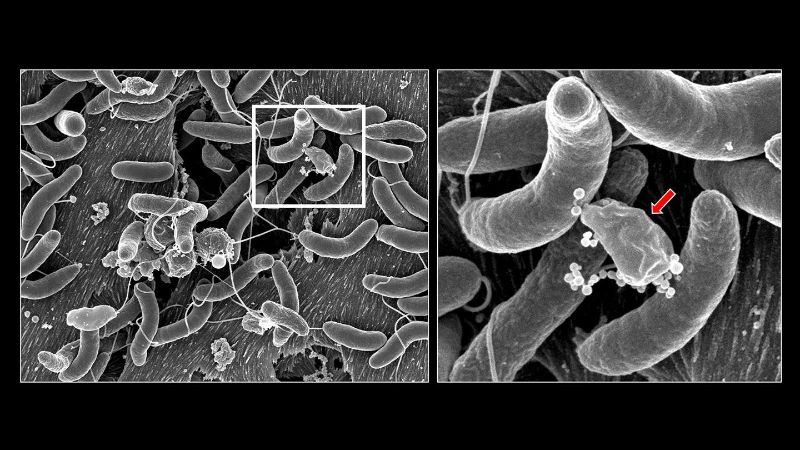
Cholera wird durch das Bakterium Vibrio cholerae verursacht, ein durch Wasser übertragener Krankheitserreger, der den Darm von Menschen infiziert, wenn sie verunreinigtes Wasser trinken. Nach dem Verschlucken beginnt Vibrio cholerae, die innere Oberfläche des Darms zu besiedeln und setzt ein Toxin auf die Epithelzellen frei. Das Toxin stört das Ionengleichgewicht an den Darmwänden und führt zu wässrigem Durchfall, der ausgeschieden wird. Schwere Cholera kann aufgrund der starken Dehydrierung zum Tod führen.
Aber das ist nicht alles, was V. cholerae anrichtet. Im Jahr 2015 veröffentlichten Forschende unter der Leitung von Professorin Melanie Blokesch an der EPFL eine bahnbrechende Arbeit, die zeigte, dass das Bakterium einen federbelasteten Speer verwendet, um benachbarte Bakterien zu stechen und deren DNA zu stehlen, während es in seiner Umgebung wächst. Dieser molekulare Speer, der als «Typ-VI-Sekretionssystem» oder T6SS bekannt ist, wurde bereits früher beschrieben und dient dem interbakteriellen Wettbewerb: «Es ist davon auszugehen, dass das Trinken von kontaminiertem Wasser in Cholera-Endemiegebieten der Welt wettbewerbsfähige T6SS-aktive V. cholerae enthält», sagt Blokesch.
Fehlende Puzzlestücke
Frühere Studien haben gezeigt, dass Darmpathogene mit den Bakterien des Darmmikrobioms interagieren müssen, um sich in dieser Umgebung zu etablieren. Sie tun dies mit einer Vielzahl von Taktiken, die von der Konkurrenz um Nährstoffe bis hin zu einem regelrechten Krieg zwischen den Bakterien reichen. Mehrere Studien haben nahegelegt, dass Darmpathogene ihre T6SS-Speerspitze einsetzen, um die Darmnische zu räumen und ihre eigene Ansiedlung zu fördern.
Es ist jedoch schwierig zu untersuchen, wie V. cholerae mit dem Darmmikrobiom interagiert. Normalerweise würden Forschende ein standardisiertes Modell für erwachsene Tiere entwickeln, aber V. cholerae ist dafür berüchtigt, erwachsene Tiere im Vergleich zum Menschen relativ schlecht zu besiedeln. Das bedeutet, dass die Forschenden auf Jungtiere zurückgreifen müssen, denen jedoch das reife Mikrobiom fehlt, mit dem V. cholerae interagiert, sobald es beginnt, den Darm zu besiedeln.
In der Zwischenzeit haben viele Studien gezeigt, dass die Resistenz gegen die Besiedlung durch V. cholerae und andere infektiöse Bakterien in hohem Masse von den sogenannten «kommensalen» Mikroben im Darm abhängt. Kommensale Mikroben, insbesondere solche aus dem menschlichen Darm, sind im Hinblick auf die Interaktion mit V. cholerae noch nicht sehr gut erforscht.
Darmresistenz
In einer in Nature Communications veröffentlichten Arbeit hat die Gruppe von Blokesch nun untersucht, wie V. cholerae mit Bakterien der menschlichen Mikrobiota interagiert. Die Forschenden untersuchten eine kleine Sammlung von Kommensalen menschlicher Probanden, die mehrere Bakterienarten wie Escherichia coli, Enterobacter cloacae und verschiedene Klebsiella-Isolate enthielten.
Ihre Ergebnisse zeigten, dass zwar mehrere Arten von Darmbakterien nach T6SS-vermittelten Angriffen durch V. cholerae dezimiert werden, eine bedeutende Untergruppe jedoch resistent ist. Insbesondere schirmen sich einige Klebsiella-Darmarten gegen die T6SS-Angriffe von V. cholerae mit einer Polysaccharidkapsel ab, die für so genannte «eingekapselte» Bakterien charakteristisch ist.
Da es sich um ein hocheffizientes Tötungsinstrument handelt, haben Bakterien wie V. cholerae, die T6SS verwenden, auch Möglichkeiten, sich selbst zu schützen, um eine Selbstvergiftung zu vermeiden. Zu diesem Zweck produzieren die T6SS nutzenden Bakterien spezifische Immunproteine, die die toxischen Wirkungen des T6SS blockieren.
Die Studie ergab jedoch, dass sich einige Mitglieder der menschlichen Mikrobiota vor T6SS-Angriffen schützen, ohne den Weg über Immunproteine zu gehen. Insbesondere zeigte die Studie, dass E. cloacae – selbst ein opportunistisches Pathogen – sich wehrt, indem es V. cholerae zuerst mit seinen eigenen, überlegenen T6SS-Waffen tötet.
«Diese Arbeit gibt uns neue Einblicke in das Verhalten von Bakteriengemeinschaften in der Darmmikrobiota und wie die Abwehr von T6SS-Vergiftungen Bakterienpopulationen helfen könnte, sich gegen eindringende Krankheitserreger zu verteidigen», sagt Melanie Blokesch. Sie betont aber auch, dass die Studie in vitro durchgeführt wurde, was bedeutet, dass weitere Studien erforderlich sind, um ein vollständigeres Bild zu erhalten.
«Nichtsdestotrotz könnte unsere Arbeit als Ausgangspunkt für die rationelle Entwicklung von T6SS-abgeschirmten probiotischen Stämmen dienen, die in der Lage sind, defekte Kolonisationsbarrieren wiederherzustellen oder die Effizienz der Barrieren zu verbessern», schliessen die Verfassenden.
Abschliessend hebt Blokesch die Grosszügigkeit der Kolleginnen und Kollegen hervor, die Bakterienstämme für diese Studie zur Verfügung gestellt haben. Sie betont auch, dass es ohne die wunderbare Zusammenarbeit mit Olaya Rendueles und Eduardo Rocha am Institut Pasteur in Paris sehr viel schwieriger gewesen wäre, neue Wege zu beschreiten, einschliesslich der Klebsiella-Biologie.
«Noch mehr als die wissenschaftliche Botschaft hat mir der kollaborative Aspekt (innerhalb und ausserhalb des Labors) gefallen», stimmt Nicolas Flaugnatti, Postdoc in der Blokesch-Gruppe und Erstautor dieser Studie, zu.