Das Protein hinter der Immuntherapieresistenz
Die Immuntherapie ist ein innovativer Ansatz zur Behandlung von Krebs, bei dem das eigene Immunsystem gegen den Tumor eingesetzt wird. Das zunehmende Wissen über die Mechanismen, mit denen der Körper Immunreaktionen reguliert, hat den Kampf gegen den Krebs grundlegend verändert.
Doch trotz der hohen Erfolgsquoten stösst die Immuntherapie immer wieder auf ein hartnäckiges Hindernis: Tumorzellen entziehen sich häufig dem «Radar» der Immunzellen, die sie zerstören wollen. Dies wiederum führt zu einer Therapieresistenz. Daher ist es notwendig, die Mechanismen besser zu verstehen, mit denen sie umgangen werden kann..
Eine neue Studie unter der Leitung von Forschenden der EPFL hat nun ein Protein aufgedeckt, das eine Schlüsselrolle dabei spielt, dass Tumore der Zerstörung durch das Immunsystem entgehen. Das Protein mit dem Namen «fragile X mental retardation protein» (FMRP) reguliert ein Netzwerk von Genen und Zellen in der Mikroumgebung des Tumors, das dazu beiträgt, dass sich der Tumor vor Immunzellen «verstecken» kann. Normalerweise ist FMRP an der Regulierung der Proteinumsetzung und der Stabilität der mRNA in Neuronen beteiligt. Die Forschenden fanden jedoch heraus, dass es bei mehreren Krebsarten in abnormaler Weise hochreguliert ist.
Die in der Zeitschrift Science veröffentlichte Studie wurde von Forschenden der Gruppe von Douglas Hanahan am Schweizerischen Institut für Experimentelle Krebsforschung (ISREC) und der Lausanner Abteilung des Ludwig-Instituts für Krebsforschung zusammen mit Kollegen des Universitätsspitals Lausanne (CHUV) und anderen Schweizer Institutionen geleitet. Die Entdeckung hat auch zu einem Spin-off der EPFL, Opna Bio, geführt, dessen Mitarbeitende ebenfalls an der Forschung beteiligt waren.
Aber warum FMRP? Die Idee stammt aus früheren Studien, die gezeigt haben, dass Krebszellen, die FMRP von Natur aus überexprimieren, invasiv und metastatisch sind. Andere Studien zeigen, dass eine fehlende Expression von FMRP in sich entwickelnden Neuronen zu kognitiven Defekten führen kann (daher der Teil «mentale Retardierung» im Namen des Proteins).
Vor dem Hintergrund dieser Erkenntnisse untersuchten die Forschenden die Expression von FMRP in menschlichen Tumoren. Anschliessend bewerteten sie seine tumorfördernden Funktionen in Mausmodellen für Krebs und untersuchten schliesslich seinen Zusammenhang mit der Prognose für menschliche Krebspatientinnen.
Die Studie umfasste mehrere Schritte zur Datenerhebung. Zunächst untersuchten die Forschenden menschliches Tumorgewebe mittels Immunfärbung auf FMRP. Die Mehrheit der Tumore wurde positiv getestet, während das entsprechende normale Gewebe nicht positiv war. Dies bedeutet, dass FMRP spezifisch und in hohem Masse in Krebszellen exprimiert wird.
Das Team ging dann zum Hauptteil seiner Forschung über, der darin bestand, die funktionelle Bedeutung von FMRP in diesen Tumoren zu bestimmen – sie exprimieren das Protein, aber was tut es?
FMRP ist am Immunsystem beteiligt
Um dies zu erforschen, entwickelten die Wissenschaftlerinnen udn Wissenschaftler Linien von sogenannten «Knockout»-Krebszellen. Knockout-Zellen oder -Organismen werden gentechnisch so verändert, dass sie ein bestimmtes Gen verlieren – «ausschalten» –, um Hinweise auf dessen Funktion zu finden. Im Wesentlichen kann jede Veränderung, die in Knockout-Zellen im Vergleich zu Zellen auftritt, die das Gen noch haben – «Wildtyp» genannt –, auf das fehlende Gen zurückgeführt werden.
In diesem Fall verwendeten die Forschenden die berühmte CRISPR-Cas9-Gene-Editing-Technik, um das Gen (FMR1) auszuschalten, das FMRP in Krebszellen der Bauchspeicheldrüse, des Dickdarms, der Brust und der Hautmelanozyten der Maus produziert. Anschliessend verglichen sie die FMRP-Knockout-Krebszellen mit Krebszellen, die noch das FMR1-Gen hatten und somit das FMRP-Protein exprimierten.
Die Forschenden bewerteten die Überlebensraten von Mäusen mit Tumoren, die FMRP-Knockout-Krebszellen enthielten, und solchen mit FMRP-Wildtyp-Zellen, zunächst bei Mäusen, deren Immunsystem beeinträchtigt war. Der Vergleich ergab ähnliche Überlebensraten. Als sie die Knockout-Tumore mit Wildtyp-Tumoren verglichen, die in Mäusen mit gut funktionierendem Immunsystem wuchsen, stellten sie fest, dass die Tumore ohne FMRP langsamer wuchsen und die Tiere länger überlebten.
Dieser Teil der Studie zeigte, dass FMRP nicht an der Stimulierung des Tumorwachstums an sich beteiligt ist, sondern vielmehr das adaptive Immunsystem (der Teil unseres Immunsystems, den wir mit Impfstoffen «trainieren») beeinflusst.
Dies wurde auch durch die Beobachtung bestätigt, dass Wildtyp-Tumore nur sehr wenige infiltrierende T-Lymphozyten aufwiesen, während Knockout-Tumore stark entzündet waren. Die Entnahme von T-Zellen aus den FMRP-Knockout-Tumoren führte dazu, dass diese schneller zu wachsen begannen und die Überlebensrate der Mäuse sank, was bedeutet, dass FMRP in irgendeiner Weise daran beteiligt ist, dass sich Tumore dem Immunsystem entziehen.
Wie sich Tumore mit FMRP gegen Immunzellen verteidigen
Das Team fuhr mit der molekulargenetischen Profilierung von Knockout- und Wildtyp-Tumoren fort. Dabei zeigten sich erhebliche Unterschiede in der Gentranskription im gesamten Genom, was darauf hindeutet, dass FMRP mit mehreren Genen interagiert. Darüber hinaus wiesen die Tumore deutliche Unterschiede in der Häufigkeit von Krebszellen, Makrophagen und T-Zellen auf, was ein weiterer Hinweis auf die Rolle von FMRP bei der Modulation von Komponenten des Immunsystems ist.
In der nächsten Phase der Studie wurde die Produktion spezifischer Faktoren untersucht, die mit den unterschiedlichen Immunreaktionen – Ausweichen oder Angriff – in Verbindung stehen. Es stellte sich heraus, dass die Tumore, die FMRP exprimieren, Interleukin-33 produzieren, ein Protein, das die Produktion von regulatorischen T-Zellen anregt, einer spezialisierten Subpopulation von T-Zellen, die Immunreaktionen hemmen. Sie produzieren auch Protein S, ein Glykoprotein, von dem bekannt ist, dass es das Tumorwachstum fördert. Schliesslich produzieren die Tumore Exosomen – Zellorganellen, die nachweislich die Produktion einer Art von Makrophagenzellen auslösen, die normalerweise bei der Wundheilung und Gewebereparatur helfen. Alle drei Faktoren zusammengenommen sind immunsuppressiv und tragen dazu bei, den Tumor vor Angriffen durch T-Lymphozyten zu schützen.
Im Gegensatz dazu haben die FMRP-Knockout-Tumorzellen alle drei Faktoren (Interleukin-33, Protein S und Exosomen) herunterreguliert, während sie ein anderes Chemokin namens «C-C-Motiv-Chemokin-Ligand 7» (CCL7) hochreguliert haben, das die Rekrutierung und Aktivierung von T-Zellen unterstützt. Dieser Prozess wird durch die Induktion immunstimulierender (und nicht immunsuppressiver) Makrophagen weiter unterstützt. Diese Zellen produzieren drei weitere entzündungsfördernde Proteine, die mit CCL7 bei der Rekrutierung von T-Zellen zusammenwirken.
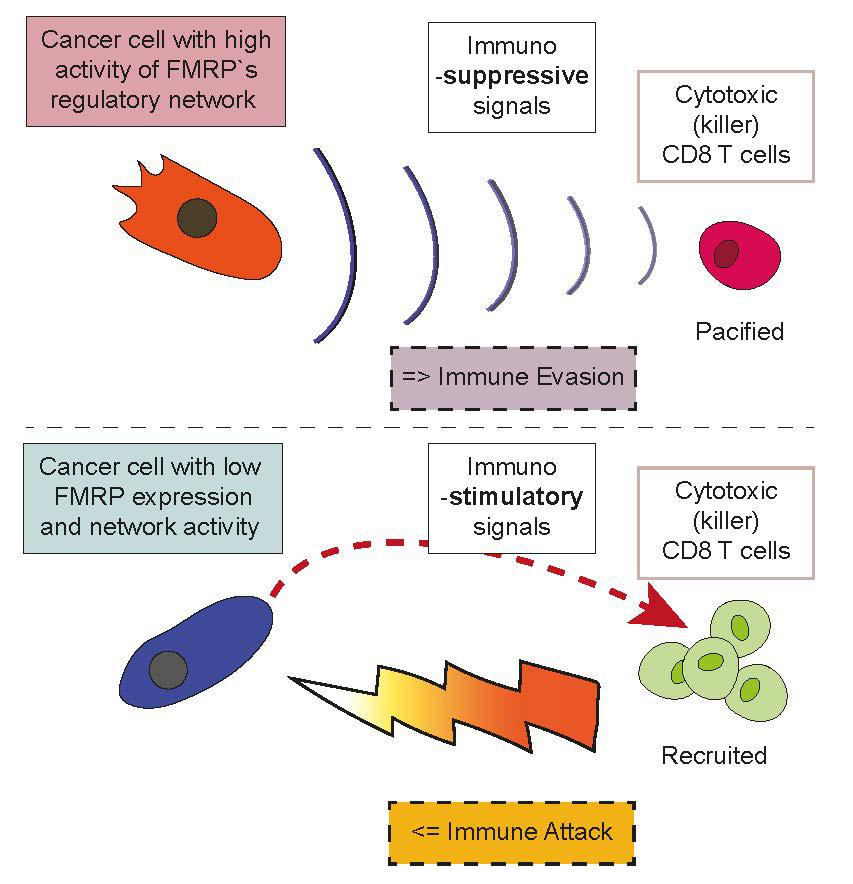
Krebszellen mit hoher und niedriger FMRP Aktivität beeinflussen immunosuppressive oder immunstimulierende Signale. Bildrechte: Agnieszka Chryplewicz und Douglas Hanahan
Vorhersage von Immuntherapie-Ergebnissen bei menschlichen Patientinnen
Im klinischen Kontext stellt sich die Frage, ob der FMRP-Spiegel eine Prognose für Patientinnen und Patienten liefern kann, die sich einer Immuntherapie unterziehen. Wider Erwarten waren sowohl die mRNA des FMR1-Gens als auch die FMRP-Proteinspiegel unzureichend für die Vorhersage des Behandlungserfolgs in Kohorten von Krebspatienten.
Um dieses Problem zu lösen, stützten sich die Forschenden auf die Tatsache, dass FMRP in der Zelle die Stabilität der mRNA durch direkte Bindung auf- und abwärts moduliert. Das bedeutet, dass FMRP die RNA-Spiegel verändern könnte, die in Transkriptom-Datensätzen erfasst werden könnten, um eine «Gensignatur» zu definieren, mit deren Hilfe seine funktionelle Aktivität verfolgt werden könnte. Der Ansatz funktionierte und ermöglichte es den Forschenden, eine Gensignatur der krebsregulierenden Aktivität von FMRP mit einem Netzwerk von 156 Genen zu verfolgen.
Die Signatur der FMRP-Krebsnetzwerkaktivität erwies sich als prognostisch für ein schlechtes Überleben bei mehreren menschlichen Krebsarten, was mit den immunsuppressiven Effekten von FMRP übereinstimmt, und stand bei einigen Patientinnen in Zusammenhang mit einem schlechten Ansprechen auf eine Immuntherapie.
Die Arbeit zeigt, dass FMRP ein Netzwerk von Genen und Zellen in der Mikroumgebung des Tumors reguliert, die alle dazu beitragen, dass sich der Tumor der Zerstörung durch das Immunsystem entziehen kann.
Douglas Hanahan sagt: «Nachdem ich jahrzehntelang die komplexe zelluläre Zusammensetzung solider Tumore studiert habe, bin ich persönlich erstaunt über unsere Entdeckung, dass ein kooptiertes neuronales Regulierungsprotein – FMRP – die Bildung einer vielschichtigen Schutzbarriere gegen den Angriff des Immunsystems orchestrieren kann, die folglich den Nutzen von Immuntherapien einschränkt, wodurch FMRP als neues therapeutisches Ziel für Krebs präsentiert wird.»