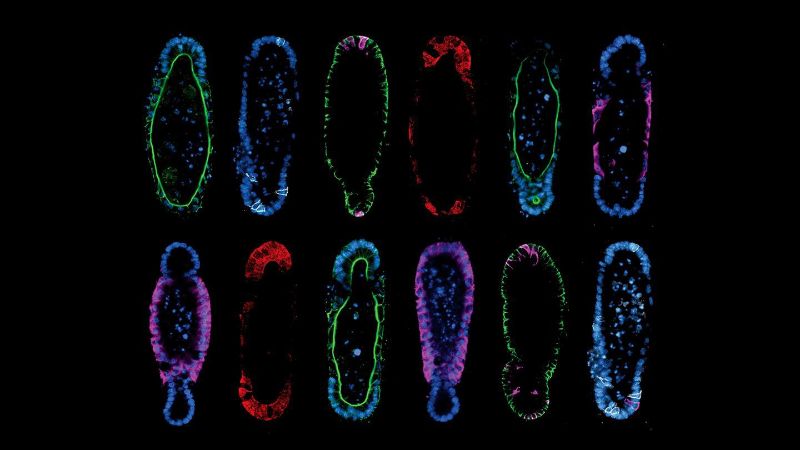
Die Form steuert das Wachstum von Organoiden
Das nächste Kapitel in der Entwicklung des Bioengineering wird durch die Fähigkeit geschrieben werden, funktionelle Miniaturorgane im Labor zu züchten. Die Anwendungsmöglichkeiten sind vielfältig: Sichere Arzneimitteltests, Krankheitsmodellierung, weniger Tierversuche und neue Erkenntnisse über die menschliche Biologie stehen ganz oben auf der Liste. Und obwohl wir noch einen langen Weg vor uns haben, hat die Entwicklung von im Labor gezüchteten Organmodellen bereits zu bemerkenswerten Durchbrüchen geführt.
Einer davon sind Organoide: Miniaturorgane, die aus Stammzellen in speziellen Hydrogelen gezüchtet werden. Der Bereich der Organoide ist bereits mehr als ein Jahrzehnt alt und hat sich in beeindruckendem Tempo weiterentwickelt, steht aber noch vor einigen grossen Herausforderungen, von denen eine darin besteht, dass es derzeit unmöglich ist, die Entwicklung von Stammzellen zu einem Organoid zu kontrollieren.
Mühe beim Wachsen
Gibt man einfach Stammzellen in ein Hydrogel und überlässt sie sich selbst, führt dies zu einer eher zufälligen («stochastischen», so der Fachbegriff) Bildung von Zellkolonien. Das heisst, obwohl wichtige Struktureinheiten, z. B. Darmkrypten, in herkömmlichen Organoiden vorhanden sind, haben die Forschenden keine Kontrolle darüber, wann, wo und wie viele von ihnen sich bilden. Die Kontrolle über diese Aspekte ist eine Voraussetzung für die Schaffung von In-vitro-Modellen, die wie echte Organe aussehen und funktionieren.
Können wir also das Wachstum und die Struktur von Organoiden kontrollieren? Diese Frage steht im Mittelpunkt der Forschung von Matthias Lütolf und seinem Team an der EPFL-Fakultät für Life Sciences. Seine Arbeit hat gezeigt, dass externe Faktoren wie die Steifheit der Umgebung tiefgreifende Auswirkungen auf die Biologie der Organoide haben können.
Eine Geschichte der Steifheit
So veröffentlichte das Lütolf-Labor 2016 eine bahnbrechende Arbeit, die zeigte, dass die Steifigkeit des Hydrogels die Entwicklung und das Wachstum von Organoiden in verschiedenen Phasen des Prozesses beeinflussen kann. Im Jahr 2020 veröffentlichte sein Team die erfolgreiche Entwicklung von Mini-Darmorganoiden, die in Mikrochips gezüchtet wurden, was neue Perspektiven für die Modellierung komplexer menschlicher Krankheiten eröffnet.
«Die Kontrolle über die Bildung von Organoiden und die daraus resultierenden Strukturen würde es uns nicht nur ermöglichen, die zugrunde liegenden morphogenetischen Mechanismen zu verstehen, sondern auch Miniatur-Organmodelle zu bauen, die ihren realen Gegenstücken ähnlicher sind», sagt Lütolf. «Da die endgültigen funktionellen Architekturen realer Organe aus dem Zusammenspiel zwischen zellulärer Selbstorganisation und extrinsischer Mikroumgebungskontrolle entstehen, müssen wir beides berücksichtigen.»
Funktion folgt Form
Nikolce Gjorevski und Mike Nikolaev, zwei ehemalige Mitglieder von Lütolfs Team, haben auf dieser Forschungslinie nach Möglichkeiten gesucht, die ansonsten stochastische Entwicklung von Organoiden zu kontrollieren. Diese Arbeit gipfelt nun in einer neuen Studie, in der Methoden vorgestellt werden, mit denen sich die Entwicklung von Organoiden, die zunehmend in vivo vorkommen, kontrollieren lässt. Die Studie wurde in Science veröffentlicht.
Die von dem Team beschriebene Methode beruht auf zwei Prinzipien. Erstens entdeckten die Forschenden, dass die Entwicklung reproduzierbar ist, wenn man von einer reproduzierbaren Ausgangsform des Organoids ausgeht, wodurch das Problem der Variabilität der Organoide gelöst wurde.
Zweitens fanden sie heraus, dass der Aufbau von Organoiden, die wie das echte Organ geformt sind, tatsächlich dazu beiträgt, dass sie eine organähnliche zelluläre Zusammensetzung und Funktion annehmen. Züchtet man beispielsweise Stammzellen in der Form einer Darmkrypta, werden sie sich wie eine Krypta organisieren und funktionieren. Das Paradigma «Form folgt Funktion» ist ein Grundprinzip der Biologie, aber die Studie zeigt, dass auch das Gegenteil der Fall ist.
Unabhängig davon mussten Gjorevski und Nikolaev auch Strategien für das eigentliche Paradigma entwickeln. Mithilfe einer als «Mikromusterung» bezeichneten Technologie formten sie die Hydrogele, die später die Organoide beherbergen sollten, von innen. Durch das Füllen von präzise gestalteten Hydrogel-Hohlräumen mit Stammzellen entstanden schliesslich Organoide, die sich an die Form der vorgeformten Hohlräume anpassten. Das Verfahren ist dem der klassischen Metallbildhauerei nicht unähnlich, bei dem geschmolzenes Metall in eine Form gegossen wird und in einer vorher festgelegten Form erstarrt.
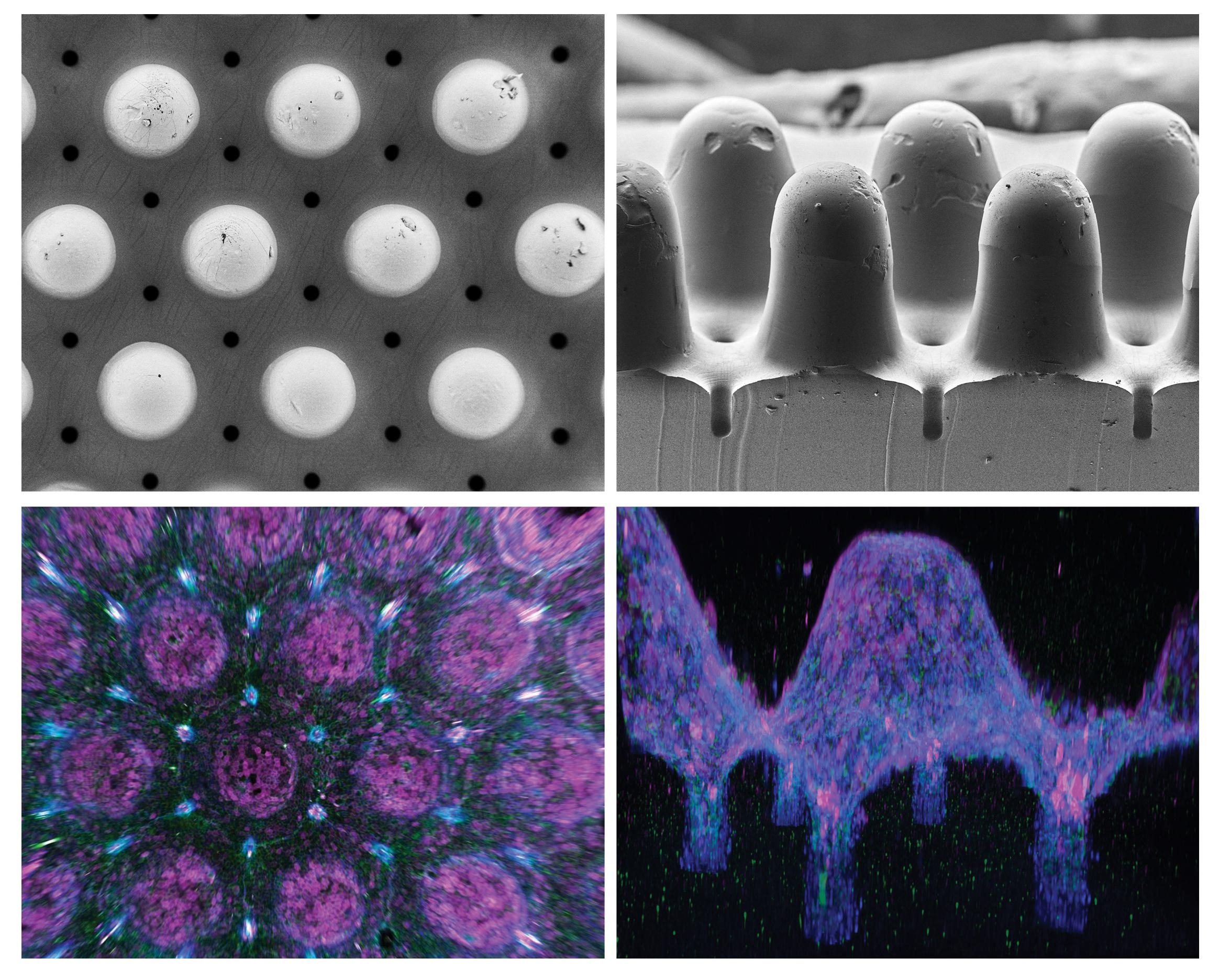
Biotechnisch hergestellte Organoide mit einer in-vivo-ähnlichen Gewebestruktur. Obere Reihe: Rasterelektronenmikroskopische Aufnahmen einer Polymerschablone, die für die Herstellung von Hydrogelsubstraten mit einer realistischen Krypten-Villus-Architektur verwendet wurde (Ansichten von oben bzw. von der Seite). Untere Reihe: 3D-Rekonstruktion von Immunfluoreszenzbildern, die ein Darmgewebe mit realistischer Krypten- und Zottenanatomie – «Peaks and Valleys» – des echten Organs zeigen. Bildrechte: Mike Nikolaev (EPFL).
Erfolgreiches Organoidwachstum
Die Ergebnisse sprechen für sich. Indem sie die Form des Hydrogels an die Anatomie des echten Darms anpassten, konnten die Forschenden die Stammzellen dazu bringen, in das Epithelgewebe mit der realistischen Anatomie der Krypten und Zotten – den «Gipfeln und Tälern» – des echten Organs zu wachsen. Dies ist besonders wichtig, da ein Grossteil der Funktionalität des Darms von den verschiedenen Zellpopulationen abhängt, die sich in diesen Strukturen befinden.
In den Krypten befinden sich zum Beispiel die Paneth-Zellen des Darms. Dabei handelt es sich um sekretorische Zellen, die für die Erhaltung der Stammzellen und für die Immunabwehr des Darmepithels wichtig sind. Der von Lütolfs Team angewandte Ansatz stellt sicher, dass Paneth-Zellen nur in den Kryptenhöhlen vorkommen, während gleichzeitig die verschiedenen Zellen des Darmgewebes an den richtigen anatomischen Stellen produziert werden.
«Unsere Methode hat sich bei der Steuerung der stammzellbasierten Organogenese als effizient erwiesen», sagt Lütolf, der heute das Institut für Translationales Bioengineering (ITB) bei Roche leitet, «unsere Organoidkulturen können zur Beantwortung von Fragen verwendet werden, die mit bestehenden Modellen – auch bei Tierversuchen – nicht beantwortet werden können, und sie können auch dazu beitragen, die Organoidtechnologie in die Praxis zu übertragen.»