Nanoplasmonische Bildgebung zeigt Proteinsekretion in Echtzeit
Zellsekrete wie Proteine, Antikörper und Neurotransmitter spielen eine wesentliche Rolle bei der Immunantwort, dem Stoffwechsel und der Kommunikation zwischen Zellen. Das Verständnis von Zellsekreten ist für die Entwicklung von Krankheitsbehandlungen von entscheidender Bedeutung, aber die derzeitigen Methoden sind nur in der Lage, die Menge der Sekrete zu erfassen, ohne Details darüber, wann und wo sie produziert werden.
Forschende des BIOnanophotonic Systems Laboratory (BIOS) der Fakultät für Ingenieurwesen und der Universität Genf haben nun ein neuartiges optisches Bildgebungsverfahren entwickelt, das einen vierdimensionalen Blick auf Zellsekrete in Raum und Zeit ermöglicht. Indem sie einzelne Zellen in mikroskopisch kleine Vertiefungen eines nanostrukturierten, vergoldeten Chips platzieren und dann ein Phänomen namens plasmonische Resonanz auf der Oberfläche des Chips hervorrufen, können sie die Sekretion während ihrer Produktion abbilden und gleichzeitig die Form und Bewegung der Zellen beobachten.
Die Wissenschaftlerinnen und Wissenschaftler sind der Ansicht, dass ihre Methode, die kürzlich in Nature Biomedical Engineering veröffentlicht wurde, ein «enormes» Potenzial für die pharmazeutische Entwicklung und die Grundlagenforschung hat, da sie einen beispiellos detaillierten Einblick in die Funktionsweise und Kommunikation von Zellen bietet.
«Ein Schlüsselaspekt unserer Arbeit ist, dass sie es uns ermöglicht, Zellen einzeln im Hochdurchsatzverfahren zu untersuchen. Kollektive Messungen der durchschnittlichen Reaktion vieler Zellen spiegeln deren Heterogenität nicht wieder... und in der Biologie ist alles heterogen, von Immunreaktionen bis zu Krebszellen. Deshalb ist Krebs so schwer zu behandeln», sagt BIOS-Leiterin Hatice Altug.
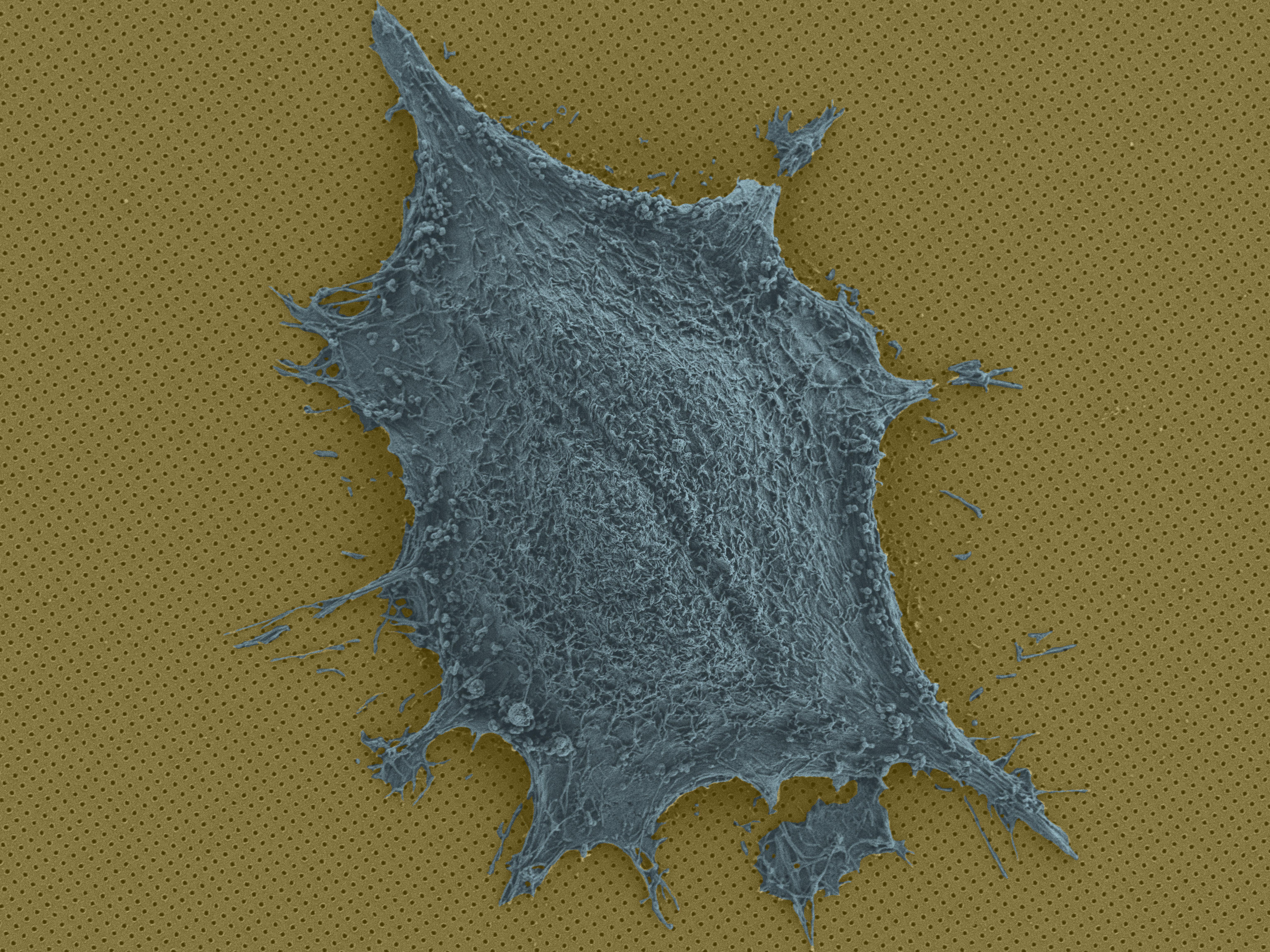
Single cell on a chip © BIOS EPFL
Eine Million Sensorelemente
Das Herzstück der Methode der Wissenschaftlerinnen ist ein 1 cm2 grosser nanoplasmonischer Chip, der aus Millionen winziger Löcher und Hunderten von Kammern für einzelne Zellen besteht. Der Chip besteht aus einem nanostrukturierten Goldsubstrat, das mit einem dünnen Polymernetz überzogen ist. Jede Kammer ist mit einem Zellmedium gefüllt, um die Zellen während der Bildgebung am Leben und gesund zu erhalten.
«Zellsekrete sind wie die Worte der Zelle: Sie breiten sich dynamisch in Zeit und Raum aus, um sich mit anderen Zellen zu verbinden. Unsere Technologie erfasst die entscheidende Heterogenität in Bezug darauf, wo und wie weit diese ‹Worte› reisen», sagt BIOS-Doktorand und Erstautor Saeid Ansaryan.
Der nanoplasmonische Teil kommt dank eines Lichtstrahls zustande, der die Goldelektronen in Schwingung versetzt. Die Nanostruktur ist so beschaffen, dass nur bestimmte Wellenlängen sie durchdringen können. Wenn auf der Oberfläche des Chips etwas geschieht, das das durchfallende Licht verändert, z. B. eine Proteinausscheidung, verschiebt sich das Spektrum. Ein CMOS-Bildsensor (Complementary Metal Oxide Semiconductor) und eine LED übersetzen diese Verschiebung in Intensitätsänderungen auf den CMOS-Pixeln.
«Das Schöne an unserem Gerät ist, dass die, über die gesamte Oberfläche verteilten, Nanolöcher jeden Punkt in ein Sensorelement verwandeln. So können wir die räumlichen Muster der freigesetzten Proteine unabhängig von der Position der Zelle beobachten», sagt Ansaryan.
Die Methode hat es den Forschenden ermöglicht, einen Blick auf zwei wesentliche zelluläre Prozesse zu werfen – Zellteilung und Zelltod – und empfindliche Antikörper bildende menschliche Spender-B-Zellen zu untersuchen.
«Wir haben den Zellinhalt gesehen, der bei zwei Formen des Zelltods freigesetzt wird: Apoptose und Nekroptose. Bei letzterer wird der Inhalt in einem asymmetrischen Ausbruch freigesetzt, was zu einer Bildsignatur oder einem Fingerabdruck führt. Dies wurde bisher noch nie auf Einzelzellebene gezeigt», sagt Altug.

Einzelzell-Mikrowellen Anordnung © BIOS EPFL
Screening auf Zelleignung
Da die Zellen bei dieser Methode in ein nahrhaftes Zellmedium getaucht werden und keine giftigen Fluoreszenzmarker wie bei anderen bildgebenden Verfahren benötigt werden, können die untersuchten Zellen leicht wiedergewonnen werden. Dies verleiht der Methode ein grosses Potenzial für die Entwicklung von Arzneimitteln, Impfstoffen und anderen Behandlungen, z. B. um den Forschenden zu helfen, zu verstehen, wie Zellen auf verschiedene Therapien auf individueller Ebene reagieren.
«Da die Menge und das Muster der von einer Zelle produzierten Sekrete stellvertretend für ihre Gesamtwirksamkeit stehen, können wir uns auch Anwendungen in der Immuntherapie vorstellen, bei denen man die Immunzellen von Patienten untersucht, um die wirksamsten zu identifizieren, und dann eine Kolonie dieser Zellen bildet», sagt Ansaryan.