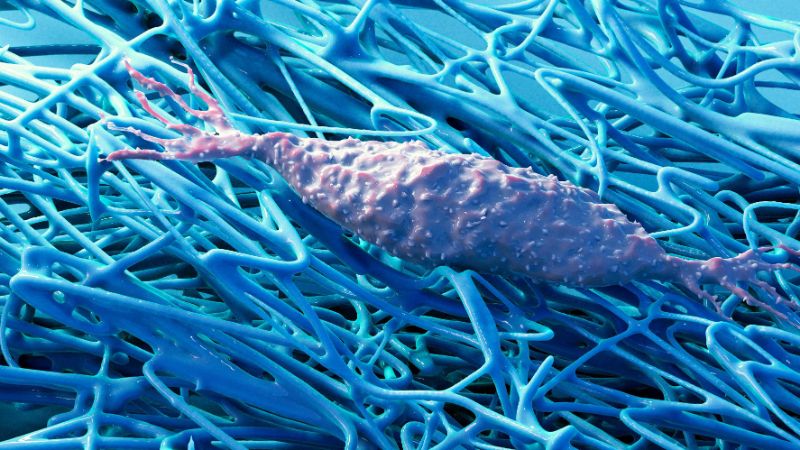
Wie sich Zellen und ihre Umgebung während des Wachstums beeinflussen
Das Wichtigste in Kürze
- Mit einem neuen Gewebekultur-System lassen sich nicht nur menschliche Zellen kultivieren, sondern auch das Fasergeflecht, das sie natürlicherweise umgibt.
- Die Zellen und dieses Fasergeflecht beeinflussen einander gegenseitig, insbesondere um dadurch das Gewebewachstum zu kontrollieren.
- Mit solchen Gewebekulturen wird man in Zukunft neue Wirkstoffe testen werden können, ohne dafür Tierversuche durchführen zu müssen.
- Neue Erkenntnisse könnten unter dem Begriff Mechanomedizin helfen, Therapien gegen Fibrosen und Krebs weiterzuentwickeln.
Wie sich ein Embryo entwickelt, wie Kinder heranwachsen, Wunden heilen oder Krebs wuchert – all dies hat mit dem Wachstum von Körpergewebe zu tun. Dieses Wachstum im Detail zu verstehen, ist eines der Hauptforschungsgebiete von Viola Vogel und Mario C. Benn. Wobei die ETH-Professorin und ihr Oberassistent die ausgetretenen Pfade verlassen: Lange ging es in der Biologie darum, Zellen und die in ihnen ablaufenden biochemischen Stoffwechselvorgänge zu erforschen, oft ungeachtet ihrer natürlichen Umgebung. Vogel und Benn hingegen richten ihren Blick nun auf die extrazelluläre Matrix, eine faserartige Struktur, welche die Zellen umgibt, von den Zellen selbst hergestellt wird und ein bedeutender Bestandteil aller Gewebe ist.
Die Wechselwirklungen zwischen den Zellen und diesem Fasergeflecht sind vielfältig, und sie beruhen nicht ausschliesslich auf Biochemie, sondern auch auf Mechanik und Physik, wie Forschung der letzten Jahre immer deutlicher zeigt. So sind Zellen zum Beispiel in der Lage, von dieser Matrix mechanische Reize wahrzunehmen.
In einer In-vitro-Testumgebung haben Vogel, Benn und ihr Team nun das Gewebewachstum nachgestellt und es genau untersucht. «Unsere Studienergebnisse unterstreichen die Wichtigkeit der Wechselwirkungen von Zellen und extrazellulärer Matrix», sagt Benn. Er möchte die neuen Erkenntnisse in Zukunft medizinisch nutzen, etwa um Wundheilungsstörungen zu vermeiden oder bei der Therapie von Krebs oder Bindegewebserkrankungen.
Zellen als Verwandlungskünstler
Im Zentrum der Untersuchungen standen zwei für die Funktion menschlichen Gewebes wichtige Zelltypen, die sich ineinander verwandeln können: Fibroblasten und Myofibroblasten. Fibroblasten sitzen im Bindegewebe unserer Organe und sorgen dafür, dass die extrazelluläre Matrix ständig erneuert wird und gesund bleibt. Kommt es zu einer Verletzung oder wenn Gewebe wachsen soll, verwandeln sich die Fibroblasten zu Myofibroblasten, welche somit eine wichtige Rolle in der Wundheilung und beim Gewebewachstum übernehmen. Sie bilden nicht nur grosse Mengen extrazellulärer Matrix, sondern sind auch kräftig genug, um zum Beispiel Wunden zusammenzuziehen.
«Myofibroblasten sind bei der Wundheilung unsere Freunde», sagt Benn. Allerdings müssen sich die Myofibroblasten nach getaner Arbeit wieder in die weniger aktiven Fibroblasten zurückverwandeln. Tun sie dies nicht, kann es zur übermässigen Bildung von Narbengewebe kommen, einer Fibrose. Auch im Krebsgewebe kommen die Myofibroblasten vor, wobei ein hoher Anteil dieser Zellen bei vielen Krebsarten mit einer schlechten Prognose verbunden ist.
Dreidimensionales Untersuchungsobjekt
Was bei der Rückverwandlung der Myofibroblasten in Fibroblasten in den Zellen biochemisch abläuft, ist teilweise bekannt. Nur wenig untersucht ist hingegen, wie die extrazelluläre Matrix diese Zellumwandlung beeinflusst. «Bei den herkömmlichen Zellkulturtechniken, bei der Zellen flächig in einer Zellkulturschale wachsen, konnte man das schlecht untersuchen, denn es bildet sich dabei eine unnatürliche flächige extrazelluläre Matrix. Und sowieso wurde diese in der Forschung meist ignoriert», sagt ETH-Professorin Vogel. «Doch Zellen ohne die extrazelluläre Matrix zu untersuchen ist ähnlich, wie wenn man das Verhalten von Spinnen ohne ihr Netz studiert.»
Ganz anders in der von Vogel und Benn benutzten Technologie, die ursprünglich am Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam entwickelt und nun von den ETH-Wissenschaftler:innen verfeinert worden ist: Es handelt sich um eine mit bestimmten Proteinen beschichtete Silikon-Form, die mikroskopisch kleine dreieckige Spalten enthält und in einem Nährmedium liegt. Über eine Zeit von zwei Wochen bildet sich in diesen Spalten neues Gewebe mit einer natürlicheren extrazellulären Matrix, wobei das Gewebewachstum in einer Ecke beginnt und sich das Gewebe immer weiter ausdehnt.
Die Forschenden konnten beobachten, wie sich dabei die Myofibroblasten immer genau an der Wachstumsfront befinden, also in dem Bereich des Gewebes, das sich gerade neu bildet. Auch konnten sie zeigen, wie die Myofibroblasten in diesem Bereich neue extrazelluläre Matrix bilden – zuerst in einer provisorischen und dann in einer stabilen Form – und sie sich anschliessend in Fibroblasten zurückwandeln. «Die Vorgänge sind ähnlich wie jene in der menschlichen Unterhaut während der späten Phase der Wundheilung», sagt Benn.
Ausserdem konnten die Wissenschaftler:innen zeigen, dass die sich rasch verändernde extrazelluläre Matrix einer der Auslöser ist für die Rückwandlung der Myofibroblasten in Fibroblasten. Diese Rückwandlung wird ausserdem begünstigt, wenn ein bestimmter Fasertyp der extrazellulären Matrix – Fibronektin – von einem gedehnten in einen entspannten Zustand wechselt. Ähnlich wechselseitige Prozesse laufen wahrscheinlich auch während der Wundheilung ab.
Schliesslich störten die Wissenschaftler:innen die Zellumwandlung mit verschiedenen Wirkstoffen, welche die Zusammensetzung oder Struktur der extrazellulären Matrix verändern. Sie konnten also nachstellen, was in bestimmten Krankheitsbildern wie Fibrose oder Krebs geschieht: Dass sich die Myofibroblasten nicht wie in einem gesunden Gewebe wieder in Fibroblasten zurückwandeln, sondern dass die extrazelluläre Matrix die Myofibroblasten stabilisiert.
Künftige Mechanomedizin
Solche Minigewebekulturen sollen den Forschenden nun helfen, weitere Details des Zusammenspiels von menschlichen Zellen und ihrer extrazellulären Matrix zu entschlüsseln. Dies ist ein Forschungsansatz ohne Tierversuche, die sonst in der biomedizinischen Forschung häufig nötig sind. Ausserdem eignet sich die Technologie, um in Zukunft Wirkstoffe zu testen. «Es handelt sich hier um eine ‹Low hanging Fruit›, ein einfach zu erreichendes Ziel», sagt Benn. «Wenn wir verstehen, wie sich Myofibroblasten und Fibroblasten umwandeln, und wir dies beeinflussen können, können wir bei Krankheiten wie Wundheilungsstörungen, Fibrose und Krebs viel erreichen.»
Benn und Vogel sprechen denn auch von einer künftigen Mechanomedizin. Sie meinen damit eine medizinische Anwendung von Erkenntnissen aus der Mechanobiologie, also dem Studium, wie Zellen mechanische Signale wahrnehmen und verarbeiten können.
Und schliesslich möchten die Forschenden damit neue Diagnosemöglichkeiten zur Früherkennung von fibrotischem Gewebe schaffen. «Bei vielen Erkrankungen, wie zum Beispiel der Lungenfibrose, ist es für eine erfolgreiche Behandlung wichtig, dass die Krankheit frühzeitig erkannt wird», sagt Benn. Die krankheitsverursachenden Myofibroblasten lassen sich im Lungengewebe allerdings bisher nur schlecht nachweisen. Benn hofft, dass er durch das Studium der extrazellulären Matrix Biomarker findet, um damit Fibrosen und ähnliche Gewebekrankheiten früher und einfacher feststellen zu können.