Energieschub für Krebsbekämpfungszellen durch modifiziertes Protein
Eine der vielen Behandlungsmöglichkeiten, die heute für Krebs zur Verfügung stehen, ist die Immuntherapie, bei der das Immunsystem des Patienten dazu angeregt wird, Lymphozyten (z. B. T-Zellen) zu produzieren, die dann den Tumor abtöten. Ohne Immuntherapie sind die Lymphozyten von Patientinnen und Patienten im Allgemeinen machtlos gegen die Krankheit. Diese Form der Behandlung hat sich als wirksam erwiesen, aber sie hat einen grossen Nachteil: Sie wirkt nur bei 20-30 % der Erkrankten. Ein Grossteil der Krebspatientinnen profitiert nicht von den aktuellen Krebsimmuntherapien.
Teamarbeit
Forschende auf der ganzen Welt arbeiten hart daran, diesen Prozentsatz zu erhöhen. Am Laboratory of Biomaterials for Immunoengineering unter der Leitung von Prof. Li Tang, innerhalb des Instituts für Bioengineering und der Fakultät für Ingenieurwissenschaft und Technologie der EPFL, hat eine Gruppe von Forschenden die gemeinsamen Bemühungen von sechs Forschungslabors an Universitäten in verschiedenen Ländern angeführt, um eine neue Methode zu untersuchen, die die Immuntherapie effektiver macht. Das internationale Team – bestehend aus 22 Expertinnen und Experten aus den Bereichen Biologie und Immunologie sowie Bioengineering und Biocomputing – hat seine Ergebnisse soeben in Nature Immunology veröffentlicht.

Professor Li Tang © Alain Herzog / 2021 EPFL
Müde T-Zellen ankurbeln
«Die Mehrheit der Krebsbetroffenen spricht nicht auf eine Immuntherapie an – das ist ein grosses Hindernis, das wir überwinden müssen», sagt Tang: «Eine Erklärung könnte sein, dass der Prozess des Eindringens in einen Tumor und der Bekämpfung von Krebszellen die Lymphozyten ermüdet und sie zu müde werden, um das Fortschreiten des Tumors aufzuhalten. Der wissenschaftliche Begriff dafür ist 'T-Zell-Erschöpfung'. Die Zellen sprechen nicht – oder nicht mehr – auf eine Immuntherapie an.»
Die neue Methode der Forschenden besteht darin, ein neu entwickeltes Protein namens Interleukin-10-Fc-Fusionsprotein zu den Immuntherapie-Medikamenten hinzuzufügen: «Interleukin-10 kann unser Immunsystem je nach Szenario stärken oder unterdrücken. Bis zu unserer Forschung war jedoch sehr wenig darüber bekannt, wie genau es mit tumorinfiltrierenden T-Zellen interagiert», sagt Yuqing Xie, Doktorand in Tangs Labor. «Aber wir scheinen einen neuen Mechanismus gefunden zu haben, der erschöpfte T-Zellen wiederbeleben könnte.» Seine Tests deuten darauf hin, dass Interleukin-10-Fc wie ein Energie-Booster wirkt und den Lymphozyten einen zweiten Schub gibt, damit sie reaktiviert werden und weiter gegen Tumore kämpfen können. Dr. Yugang Guo, Wissenschaftler in Tangs Labor, erklärt: «Mit diesem Protein sind wir in der Lage, den Stoffwechsel der T-Zellen umzuprogrammieren und ihre Expansion und Zerstörungskraft gegen Krebs zu steigern.»

Ein Cartoon zeigt T-Zellen, die abgereichert und dann durch Interleukin-10-Fc geboostet wurden. ©LBI/Xiaomeng Hu/2021 EPFL
Bis zu 90 % Heilungsrate
Die Methode wurde an Mäusen mit eindeutigen Ergebnissen getestet – bis zu 90 % der erkrankten Tiere konnten den Krebs besiegen. «Interleukin-10-Fc scheint hochwirksam zu sein. Es wirkt in Synergie mit adoptiven T-Zell-Transfer-Immuntherapien, wie z.B. der CAR-T-Therapie, oder Immun-Checkpoint-Inhibitoren, was zur Ausrottung etablierter solider Tumore und zu dauerhaften Heilungen bei der Mehrheit der behandelten Mäuse führt. Unsere Methode scheint die bestehenden Immuntherapien gegen solide Tumore, die bekanntermassen schwer zu heilen sind, zu verbessern», so Tang. Darüber hinaus wurden bei den Tests keine offensichtlichen Nebenwirkungen beobachtet, was für zukünftige klinische Studien vielversprechend ist. Die Forscher Dr. Yugang Guo, Yuqing Xie und Prof. Li Tang haben diese neue Therapie international zum Patent angemeldet und werden sie bald in klinischen Studien an Patientinnen und Patienten erproben.
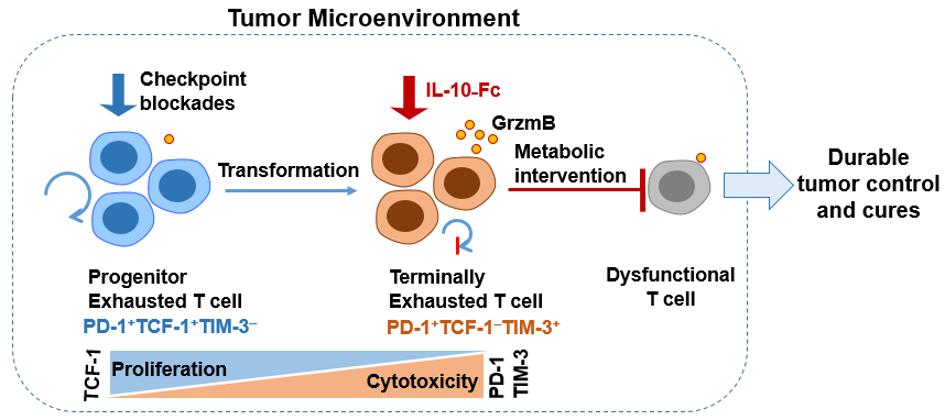
Im Gegensatz zu Immun-Checkpoint-Blockaden expandiert Interleukin-10-Fc (IL-10-Fc) direkt die terminal dezimierten T-Zellen und fördert deren Effektor-Funktion durch metabolische Reprogrammierung, was zu einer dauerhaften Tumorkontrolle führt. © LBI/Yugang Guo/2021 EPFL
Engpass-Durchbruch
Unter den tumorinfiltrierenden T-Zellen gibt es eine Untergruppe, die als «terminale erschöpfte CD8+ T-Zellen» bezeichnet wird und auf die meisten existierenden Immuntherapien, einschliesslich Immun-Checkpoint-Blockaden, nicht anspricht. Es ist bekannt, dass sie schwer zu reaktivieren ist. Die von Prof. Li Tang geleitete Studie zeigt, dass die metabolische Reprogrammierung dieser Zellen durch ein Molekül, den so genannten mitochondrialen Pyruvat-Carrier, ausreicht, um die Funktionalität von terminal erschöpften CD8+ T-Zellen zur Krebsbekämpfung wiederherzustellen. Dieser Befund legt den Grundstein für die weitere Identifizierung von Stoffwechselanregungen, die für die Wiederbelebung von terminal erschöpften CD8+ T-Zellen benötigt werden, einem derzeitigen großen Engpass auf dem Gebiet der Krebsimmuntherapie.
