L’univers miraculeux des antennes moléculaires
Sans eux, le monde qui nous entoure serait tout noir. Contempler le bleu du ciel, lire un livre ou suivre un film d’action à la télévision… Tout cela, c’est aux photorécepteurs que nous le devons. Les photorécepteurs sont des protéines qui réagissent à la lumière et qui rendent des services inestimables chez toutes les formes de vie: elles permettent aux algues unicellulaires de savoir dans quelle direction nager et aux végétaux de se tourner vers le soleil. Comme l’être humain, de nombreux animaux captent la lumière par le biais d’organes très développés, les yeux, et traitent les signaux dans le cerveau pour générer des impressions complexes. Chaque jour, ces photorécepteurs règlent aussi notre horloge interne.
Le principe est toujours le même: les protéines sont intégrées dans les membranes – des enveloppes lipidiques qui entourent les cellules – et convertissent la lumière en signal biologique. La première et essentielle étape de leur activation consiste toujours à basculer un commutateur de la position «arrêt» à la position «marche». Mais comment donc l’énergie contenue dans un faisceau lumineux entraîne- t-elle dans le photorécepteur des transformations qui sont à l’origine de toutes les autres réactions? «Jusqu’ici, personne n’a encore répondu à cette question fondamentale», explique Gebhard Schertler, chef de la division de recherche Biologie et Chimie, qui se consacre depuis plus de trente ans à la recherche sur les protéines de ce type. Pour résoudre cette énigme et d’autres en suspens, les chercheurs du PSI étudient la structure des protéines photosensibles et leurs transformations dynamiques.
Comment le chat retombe sur ses pattes
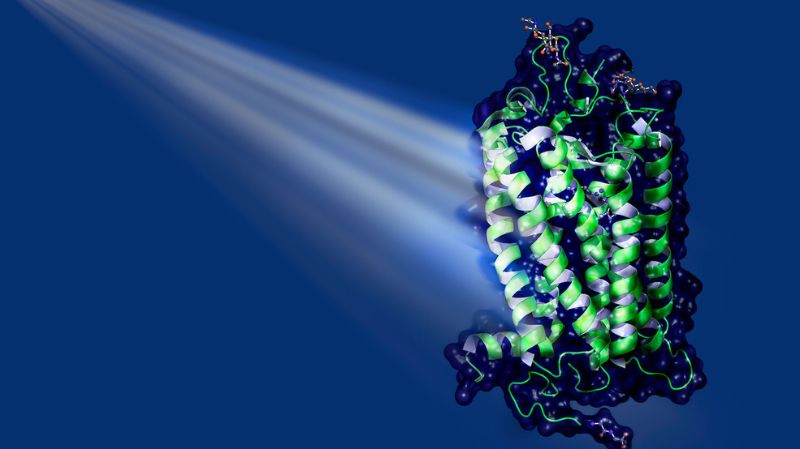
Les processus de commutation qui se jouent en permanence dans nos yeux sont extrêmement rapides et ne durent que quelques milliardièmes de seconde. Pour explorer ces processus ultrarapides, il faut disposer d’installations de recherche très spéciales, comme le laser à rayons X à électrons libres SwissFEL, la plus récente des grandes installations de recherche au PSI, inaugurée en 2016. «Avec lui, nous faisons passer la biologie structurale au niveau supérieur », relève Jörg Standfuss, scientifique au Laboratoire de recherche biomoléculaire du PSI. Le SwissFEL permet aux chercheurs de réaliser une espèce de vidéo à ultrahaute résolution des processus chimiques pour les étudier dans les moindres détails. «Cela nous donne les moyens de vraiment comprendre le fonctionnement de ces protéines photosensibles », souligne le chercheur. La famille des rhodopsines fait partie des photorécepteurs naturels les plus importants chez l’être humain et chez l’animal. Dans l’oeil humain, ces protéines sont partie intégrante des bâtonnets, ces cellules sensorielles spécialisées dans la perception de la lumière et de l’obscurité.
Une petite molécule allongée est fixée au milieu des rhodopsines: le rétinal, un dérivé de la vitamine A. Lorsque de la lumière atteint le rétinal, la molécule absorbe celle-ci et change de forme (voir illustration à gauche). Au cours de ce processus, le rétinal modifie sa structure tridimensionnelle, ce qui entraîne des transformations structurelles dans la protéine. Celle-ci peut alors se lier à d’autres protéines dans la cellule, appelées «protéines G», ce qui met en branle une cascade de processus biochimiques et biophysiques. A terme, ces derniers génèrent par exemple la perception d’un éclat lumineux.
Valérie Panneels, scientifique au Laboratoire de recherche biomoléculaire du PSI, cherche à comprendre précisément comment se déroule la modification de la structure du rétinal à l’intérieur de la protéine. «Comparons le rétinal à un chat qui choit d’un arbre sur le dos, mais qui finit par retomber sur ses pattes, dit-elle. La question est alors la suivante: quels états le chat adopte-t-il pour se retourner sur le ventre lors de sa chute?» Dans le cas du chat, le processus est si rapide que l’on n’arrive pas à l’observerà l’oeil nu. Il l’est encore plus dans le cas du rétinal: ses états intermédiaires ne durent que quelques milliardièmes de seconde.
Valérie Panneels sait aujourd’hui que le chat-rétinal commence par opérer une rotation des épaules avant de se retourner sur le ventre. Mais le mystère demeure de savoir pourquoi la transformation du rétinal dans l’oeil se déroule avec une telle efficacité. «C’est l’une des réactions les plus rapides et les plus dirigées qui existent dans la nature», souligne Valérie Panneels. Toutefois, elle ne peut être efficace que si la molécule est liée à la protéine; elle ne l’est pas si elle flotte librement dans une solution.
La protéine influence donc fortement la direction de la réaction, mais la communauté scientifique ignore de quelle manière exactement. «Si l’on réussissait à répondre à cette question, la construction du SwissFEL serait déjà rentabilisée», estime Jörg Standfuss. Ces connaissances ouvriraient beaucoup de nouvelles possibilités de recherche et d’applications ultérieures dans les domaines de la médecine et de la biologie.
Pomper au lieu de voir
Au cours de l’évolution, les protéines photosensibles se sont constituées dans un autre but que la vision: elles permettent aussi à certains êtres vivants de produire de l’énergie à partir des rayons du soleil. Nombre de bactéries et d’algues unicellulaires possèdent, dans leur membrane cellulaire, des pompes contrôlées par la lumière. Il s’agit de protéines qui changent de forme lorsqu’elles sont exposées, ce qui les amène à transporter des ions – de petites particules chargées – hors de la cellule ou à l’intérieur de celle-ci. Ce mécanisme permet aux unicellulaires de s’adapter au pH, à la teneur en sel et à d’autres caractéristiques de leur environnement.
La bactériorhodopsine est une pompe actionnée par la lumière. Cette protéine qui transporte des protons est présente, entre autres, chez les halobactéries, un groupe d’organismes unicellulaires qui prospèrent dans les lacs extrêmement salés. Même si ces unicellulaires ne sont pas proches de l’homme du point de vue biologique, la bactériorhodopsine n’est guère différente de la rhodopsine humaine: elle se lie aussi au rétinal et change de forme sous l’effet de la lumière. Toutefois, elle ne se lie pas aux protéines G – en dépit de son nom, identique pour des raisons historiques – et appartient à un autre type de protéines, les opsines microbiennes.
En 2016, Jörg Standfuss a réalisé pour la première fois un film du processus de pompage d’une bactériorhodopsine. En 2020, son groupe a capturé en pleine action une autre pompe commandée par la lumière: la pompe à sodium d’une bactérie marine.
«Grâce au SwissFEL, le PSI est à la pointe de la recherche au niveau mondial dans l’étude des rhodopsines et de leurs dynamiques structurelles», relève Przemyslaw Nogly, ancien postdoc chez Jörg Standfuss et aujourd’hui responsable d’un groupe de recherche à l’ETH Zurich. Il étudie, au SwissFEL, l’halorhodopsine, une pompe à chlorure qui transporte les ions de chlorure de l’extérieur vers l’intérieur de la cellule des halobactéries. «Nous sommes particulièrement fascinés par la question de savoir comment l’énergie de la lumière absorbée est utilisée pour déclencher le transport du chlorure», raconte Przemyslaw Nogly. Entre-temps, le SwissFEL a contribué à élucider cette énigme.
Marche / Arrêt
Comprendre les antennes moléculaires naturelles qui captent la lumière fait avancer la recherche fondamentale et ce qu’on appelle l’«optogénétique». Les chercheurs utilisent cette technologie pour tenter d’intégrer des protéines photosensibles en guise de minuscules commutateurs dans des cellules animales ou humaines. Leur idée est de réussir à activer et à désactiver certains processus dans les cellules cibles, simplement en les exposant à la lumière. Et leur espoir est de fournir les fondements pour mieux connaître les processus biologiques qui se jouent dans notre organisme, ouvrant ainsi la voie à de nouveaux traitements.
Au début des années 2000, des chercheurs des Etats-Unis et d’Europe ont intégré pour la première fois un photorécepteur de manière ciblée dans des cellules nerveuses pour contrôler leur activité (voir infographie p. 16). Il s’agissait de la channelrhodopsine, un canal protéique prélevé sur une algue d’eau douce. Son patrimoine génétique a été intégré dans les cellules nerveuses de rats, qui se sont mises à produire le canal ionique en bacs de laboratoire. Exposée à la lumière bleue, la channelrhodopsine s’ouvrait pour laisser entrer des ions chargés positivement dans les cellules, qui étaient alors activées. Ces canaux ioniques nouvellement introduits sont donc une voie pour contrôler des cellules nerveuses en temps réel, avec de la lumière.
Mais tous les instruments optogénétiques développés jusqu’ici présentent un inconvénient majeur, explique Valérie Panneels: ils ne sont presque exclusivement intégrables que dans des cellules nerveuses. «Nous travaillons à présent au développement de protéines optogénétiques qui pourraient être aussi intégrées dans d’autres cellules et pour d’autres fonctions, dit-elle. Pratiquement dans n’importe quel organe.» Cela élargirait radicalement les possibilités d’application de la technologie.
La cible idéale est la famille des récepteurs, dont la rhodopsine fait également partie. Les récepteurs couplés aux protéines G (RCPG) sont présents dans presque toutes les cellules de notre organisme et y assurent de nombreuses fonctions: odorat, goût, déclenchement d’une réaction inflammatoire, régulation du rythme cardiaque, etc. Les RCPG constituent donc des cibles extrêmement importantes pour des principes actifs en médecine. On estime que plus d’un tiers des médicaments homologués déploient leur effet par le biais de cette famille de protéines.
De grands projets
Avec un groupe de recherche suisse et européen, Gebhard Schertler aimerait jeter les bases du développement de commutateurs universels contrôlables par la lumière au cours des prochaines années (voir infographie p. 16). Peter Hegemann, de l’Université Humboldt de Berlin, Sonja Kleinlogel, de l’Université de Berne, et Rob Lucas, de l’Université de Manchester en Grande-Bretagne, font partie de ce consortium. L’objectif de leur équipe est de créer ce qu’on appelle des «protéines chimères» dotées d’une tête photosensible susceptible d’être activée et désactivée par la lumière, et d’un corps qui déclenche un processus très spécifique dans la cellule.
Mais la rhodopsine des vertébrés ne se prête pas à la réalisation de ces petits commutateurs, rappelle Gebhard Schertler. «Chaque fois que la rhodopsine est activée dans l’oeil humain, le lien entre la protéine et le rétinal est rompu, explique-t-il. Pour redevenir photosensible, le récepteur doit d’abord se régénérer.» Ce mécanisme se déroule dans une seule couche de cellules de la rétine. C’est là que la protéine est de nouveau liée au rétinal et qu’elle reforme un photorécepteur fonctionnel. «Nos photorécepteurs sont donc à usage unique et doivent être régénérés au terme d’un processus complexe, conclut le chercheur. C’est un système vraiment compliqué.»
Dans les photorécepteurs des calmars, des insectes et de nombreux invertébrés, le rétinal reste en revanche constamment lié à la protéine. Il suffit au récepteur d’absorber un nouveau rayon de lumière pour que le récepteur retrouve son état d’origine et puisse aussitôt capter le prochain faisceau lumineux. Ces rhodopsines – dites «bistables» – peuvent être constamment activées et désactivées. Et si, ensuite, la protéine pouvait être modifiée de sorte qu’on puisse par exemple l’activer avec de la lumière bleue et la désactiver avec de la lumière rouge, on disposerait du commutateur idéal.
Le secret des araignées sauteuses
Les photorécepteurs bistables, peu pris en compte par la recherche scientifique jusqu’ici, sont au coeur de ce projet de recherche. Une candidate semble prometteuse: la rhodopsine bistable de l’araignée sauteuse Hasarius adansoni, qui réagit à la couleur verte. Cette araignée, qui mesure seulement 6 millimètres, est répandue dans les serres du monde entier. Parmi ses huit yeux, deux gros sont situés à l’avant. Ces yeux antérieurs, dont la rétine est faite de quatre couches superposées, lui permettent de localiser une proie à quelques millimètres près et de la saisir d’un bond.
«Contrairement à beaucoup d’autres rhodopsines, celle de l’araignée sauteuse est stable, facile à cristalliser et à manipuler», détaille Gebhard Schertler. Les chercheurs espèrent que cette protéine fera avancer leur recherche de commutateurs moléculaires contrôlés par la lumière. A long terme, la mélanopsine – qui régule notre rythme jour-nuit dans certaines cellules nerveuses spéciales de l’oeil et qui est bistable – conviendrait elle aussi particulièrement bien. Mais personne à ce jour n’a réussi à déchiffrer la structure de la mélanopsine, car elle est trop instable en bacs de laboratoire.
Lumière en vue
Sonja Kleinlogel, de l’Université de Berne, a déjà produit une protéine chimère optogénétique bistable. Celle-ci est constituée, en tant que tête, de l’antenne collectrice de lumière de la mélanopsine et, en tant que corps, d’un récepteur présent dans les cellules bipolaires de l’oeil. Elle joue un rôle important dans la transduction du signal depuis la rétine de l’oeil en direction du cerveau. La scientifique a ainsi réussi à restaurer une grande partie de la vision chez des souris aveugles, en utilisant une thérapie génique fondée sur l’optogénétique. Mais elle a construit sa protéine optogénétique en procédant principalement par essais et par erreurs. Sa méthode ne peut donc pas être transposée à d’autres récepteurs pour le moment.
«Nous devons découvrir pourquoi la construction de Sonja Kleinlogel fonctionne, estime Gebhard Schertler. Et nous devons acquérir les connaissances nécessaires pour modifier des protéines afin qu’elles fassent ce que nous souhaitons.» Les chercheurs veulent utiliser la Source de Lumière Suisse SLS, le SwissFEL et la cryomicroscopie électronique (voir l’article en page 18) pour explorer les photorécepteurs bistables et leurs mécanismes dans la cellule, puis, sur la base de leurs connaissances, développer des prototypes d’instruments optogénétiques.
Les possibilités sont énormes: ces commutateurs contrôlables par la lumière permettraient par exemple d’explorer les fonctions cérébrales supérieures. «L’optogénétique classique modifie l’équilibre ionique dans les cellules nerveuses, explique Gebhard Schertler. Nous, en revanche, nous pourrions activer des cascades de signaux dans le cerveau, ce qui serait complètement nouveau.» Cette technologie pourrait contribuer à mieux comprendre certains troubles psychiques, comme les dépressions et la schizophrénie, voire à développer des médicaments.
Si l’on réussissait à activer et à désactiver les récepteurs couplés aux protéines G de manière ciblée, cela montrerait en outre quelles sont les fonctions concrètes d’un récepteur. Cela permettrait notamment de réduire les effets indésirables. La mise au point de nouveaux commutateurs moléculaires contrôlés par la lumière revêt une grande valeur pour le Conseil européen de la recherche (CER): en 2020, il a accordé un financement de 10 millions d’euros au projet collaboratif européen de Gebhard Schertler et de son équipe. Une fois les bases posées, cette technique s’imposera dans la recherche scientifique, Gebhard Schertler en est convaincu: «Nous sommes encore bien loin d’une boîte à outils comme celle qui existe pour l’optogénétique classique, reconnaît-il. Mais dans quelques années, nous serons capables de résoudre beaucoup d’énigmes et je pense que des centaines de laboratoires commenceront à utiliser ce genre de commutateurs RCPG photosensibles universels.»