L'ADN satellite joue un rôle clé dans la spéciation
Plus de 10% de notre génome est constitué de portions de matériel génétique répétitives et apparemment insensées, appelées ADN satellite, qui ne codent pour aucune protéine. Par le passé, certains scientifiques ont qualifié cet ADN de «poubelle génomique».
Cependant, dans une série d'articles publiés sur plusieurs années, Madhav Jagannathan, actuellement professeur assistant au département de biologie de l'ETH Zurich, et son mentor postdoctoral, Yukiko Yamashita, du Whitehead Institute du MIT, ont démontré que l'ADN satellite n'est pas un déchet, mais qu'il joue un rôle essentiel dans la cellule: il travaille avec les protéines cellulaires pour maintenir tous les chromosomes individuels d'une cellule dans un seul noyau.
Dans le dernier volet de leurs travaux, publié dans la revue Molecular Biology and Evolution, Jagannathan et Yamashita vont plus loin en proposant que le système d'organisation chromosomique rendu possible par l'ADN satellite est l'une des raisons pour lesquelles des organismes d'espèces différentes ne peuvent pas produire de descendance viable.
L'origine des espèces : édition ADN
Les scientifiques savent depuis des années que l'ADN satellite est très variable d'une espèce à l'autre. «Si vous regardez le génome du chimpanzé et le génome humain, les régions de codage des protéines sont environ 98% à 99% identiques», dit Yamashita. «Mais la partie ADN poubelle est très, très différente.»
Il s'agit des séquences du génome qui évoluent le plus rapidement. L'hypothèse précédente des scientifiques était qu'il s'agissait «simplement de déchets génétiques qui n'avaient pas d'importance, même s'ils différaient d'une espèce à l'autre», explique le professeur de l'ETH Zurich.
Mais alors qu'ils étudiaient l'ADN satellite pour la fertilité et la survie des espèces pures, Jagannathan et Yamashita ont eu leur premier indice que ces séquences répétitives pouvaient jouer un rôle dans la spéciation.
Lorsque les deux chercheurs ont supprimé une protéine appelée Prod qui se lie à une séquence d'ADN satellite spécifique chez la drosophile Drosophila melanogaster, les chromosomes des mouches se sont dispersés à l'extérieur du noyau pour former de minuscules amas de matériel cellulaire appelés micronoyaux, et les mouches sont mortes. «Mais nous nous sommes rendu compte à ce moment-là que ce morceau d'ADN satellite lié à la protéine Prod était complètement absent chez les plus proches parents de Drosophila melanogaster», explique Jagannathan.
Si ce morceau d'ADN satellite était essentiel à la survie d'une espèce mais absent d'une autre, cela pourrait signifier que les deux espèces de mouches ont évolué au fil du temps vers des séquences d'ADN satellite différentes pour le même rôle. Et puisque l'ADN satellite joue un rôle dans le maintien de tous les chromosomes ensemble, les chercheurs et leurs collègues se sont demandés si ces différences évoluées pouvaient être l'une des raisons pour lesquelles les différentes espèces sont incompatibles sur le plan reproductif.
L'histoire de deux espèces de mouches à fruits
Pour étudier comment les différences d'ADN satellite peuvent être à l'origine de l'incompatibilité reproductive, les chercheurs ont décidé de se concentrer sur deux branches de l'arbre généalogique de la mouche à fruits : le modèle de laboratoire classique Drosophila melanogaster et sa plus proche parente, Drosophila simulans. Ces deux espèces ont divergé l'une de l'autre il y a deux à trois millions d'années.
Les chercheurs peuvent accoupler une femelle Drosophila melanogaster avec un mâle Drosophila simulans, «mais le croisement génère une progéniture très malheureuse», explique M. Yamashita, «soit elle est stérile, soit elle meurt».
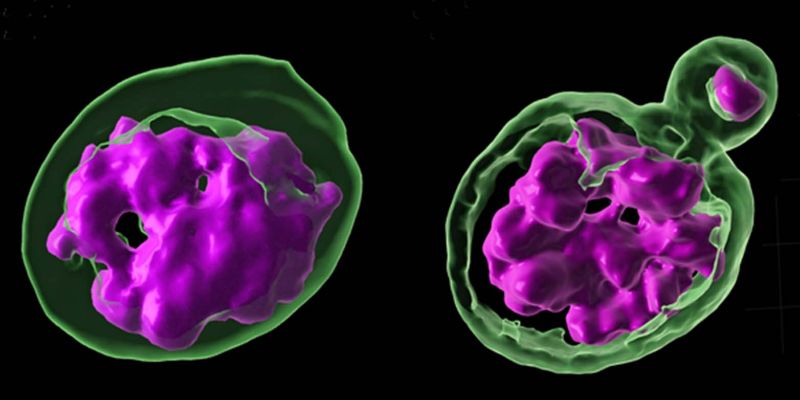
Jagannathan et Yamashita ont étudié les tissus de la progéniture pour voir ce qui conduisait ces hybrides à tomber comme des mouches. Les deux chercheurs ont remarqué quelque chose d'intéressant : le tissu des hybrides présentait exactement les mêmes caractéristiques que le tissu des mouches d'espèces «pures» dont l'ADN satellite était perturbé : les chromosomes étaient dispersés dans les cellules des deux formes et non regroupés dans le noyau.
En outre, ils ont pu créer une mouche hybride saine en mutant certains gènes des mouches parentales, appelés «gènes d'incompatibilité hybride», dont on a constaté qu'ils se localisaient dans l'ADN satellite des cellules des espèces pures. Grâce à ces expériences, les chercheurs ont pu démontrer comment ces gènes affectent l'empaquetage chromosomique chez les hybrides et identifier pour la première fois les phénotypes cellulaires qui leur sont associés.
Ces résultats suggèrent qu'en raison des mutations relativement fréquentes de l'ADN satellite, les protéines qui lient l'ADN satellite et maintiennent les chromosomes ensemble doivent évoluer pour suivre le rythme, ce qui conduit chaque espèce à développer sa propre «stratégie» pour travailler avec l'ADN satellite. Lorsque deux organismes ayant des stratégies différentes se croisent, un conflit se produit, conduisant les chromosomes à se disperser en dehors du noyau.
Dans de futures études, Jagannathan et Yamashita espèrent mettre leur modèle à l'épreuve: s'ils parviennent à concevoir une protéine capable de lier l'ADN satellite de deux espèces différentes et de maintenir les chromosomes ensemble, ils pourraient théoriquement «sauver» un hybride condamné, lui permettant de survivre et de produire une descendance viable. Cette prouesse de bio-ingénierie ne sera probablement pas réalisée avant des années: «Pour l'instant, il ne s'agit que d'un pur concept», déclare M. Yamashita.
Cet article est basé sur un récit d'Eva Frederick, du Whitehead Institute.