La propagation des antibiorésistances dans les colonies de bactéries
Ce qui ressemble au premier abord à des œuvres d’art, créées sous l’influence d’une importante dose de substances psychédéliques, sont en réalité des images prises au microscope de colonies de bactéries élevées en laboratoire sur des plaques de culture. Les chercheuses et chercheurs du département Microbiologie de l’environnement de l’Institut de recherche sur l’eau Eawag ont doté plusieurs souches bactériennes de différents gènes de protéines fluorescentes, ce qui donne ces couleurs chatoyantes. Certaines luisent en rouge, d’autres en vert.
Des éléments génétiques mobiles pour transmettre les antibiorésistances
À cette préparation s’ajoute un autre gène pour une protéine de fluorescence bleue que Yinyin Ma, Josep Ramoneda et Dave Johnson ont intégré dans ce que l’on appelle un plasmide. Les plasmides sont (contrairement aux chromosomes beaucoup plus gros) de petits éléments génétiques mobiles que les bactéries peuvent s’échanger entre elles. Ils peuvent par exemple contenir des gènes qui neutralisent l’effet d’antibiotiques, rendant ainsi les bactéries résistantes à ces substances sinon mortelles.
«Les plasmides sont le premier vecteur de transmission des antibiorésistances entre les cellules des bactéries», explique Dave Johnson. Et comme les chercheuses et chercheurs ont marqué en bleu les plasmides échangeables, on peut voir dans leurs essais ce qui se produit de manière totalement invisible dans l’environnement: Quand elles reçoivent le plasmide, les bactéries rouges apparaissent en magenta. Et les cellules vertes prennent une couleur turquoise lorsque leur cellule voisine leur offre un plasmide.
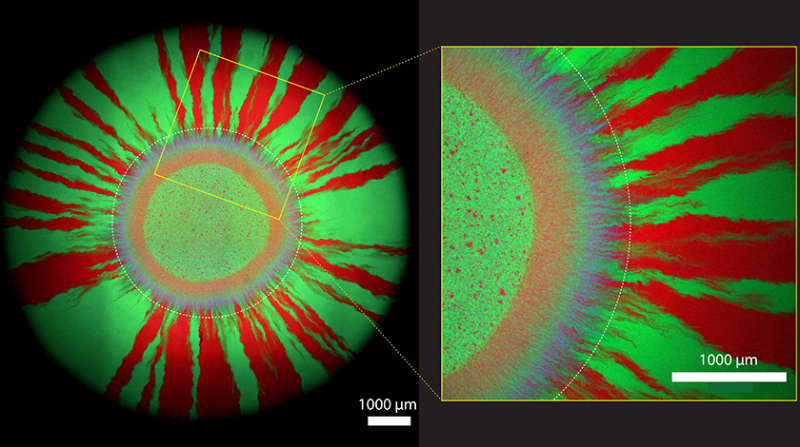
Une couronne violette encadrée de rayons rouges et verts
Le groupe dirigé par D. Johnson s’intéresse à la manière dont se propagent les antibiorésistances dans les colonies de bactéries en pleine croissance. Les essais des chercheuses et chercheurs consistaient à déposer de minuscules gouttes d’un mélange de bactéries magenta et de microbes verts sur des plaques de culture exemptes d’antibiotique. «Les colonies de bactéries croissent à l’extrême limite toujours plus vers l’extérieur», explique D. Johnson. Comme le montrent les images prises au microscope par l’équipe une semaine après la mise en place de leurs cultures bactériennes, il se forme d’abord une couronne violette (composée de cellules magenta et turquoise) autour des minuscules gouttes. C’est dans cette première zone de croissance que les bactéries échangent le plus intensivement le plasmide.
Plus tard, donc plus à l’extérieur, un motif de rayons verts et rouges se forme. À ce point, les cellules ont déjà perdu le plasmide. En effet, les cellules sans plasmide se divisent plus rapidement: elles économisent l’énergie dont ont besoin les cellules avec plasmide pour multiplier l’élément génétique supplémentaire. En d’autres termes, elles ont un avantage évolutif et font la course en tête lorsqu’il n’y a pas d’antibiotique sur la plaque de culture.
Mais sur d’autres plaques de culture, l’équipe de D. Johnson a appliqué un antibiotique, et ce à des heures différentes. Les motifs en couleur complètement différents montrent que la transmission du plasmide est la plus fréquente lorsque l’antibiotique a été administré dans une période allant de 10 à 70 heures après le début de la croissance. Visiblement, l’antibiotique agit le mieux tout au début, ou alors bien plus tard, lorsque de nombreuses cellules ont perdu leur plasmide.
Une importance mondiale croissante
Peut-on déduire de ces résultats à quel moment administrer un antibiotique à des patientes et patients humains (ou animaux)? «Non», déclare D. Johnson. Selon lui, c’est impossible, les essais en laboratoire ne pouvant être comparés que de manière très limitée avec l’utilisation d’antibiotiques en clinique. Car les humaines et les animaux abritent plus de deux souches bactériennes. Ce pourrait être l’une des raisons pour lesquelles les antibiorésistances perdurent pendant des années, par exemple dans l’intestin, sans disparaître comme sur la plaque de culture.
Dans tous les cas, de nombreuses questions restent encore à élucider. Dave Johnson a déjà son idée sur les aspects qu’il souhaite étudier ensuite avec son groupe. Ainsi, son équipe contribue pas à pas à obtenir des connaissances approfondies sur l’échange génétique entre bactéries. Les chercheuses et chercheurs ont conscience que de telles connaissances revêtent une importance mondiale croissante: «Nous sommes d’avis qu’il est indispensable de mieux comprendre l’interaction temporelle entre transmission de plasmide et perte de plasmide dans les communautés microbiennes complexes pour mieux maîtriser la crise globale de l’antibiorésistance», constate l’équipe en conclusion de son récent article scientifique.