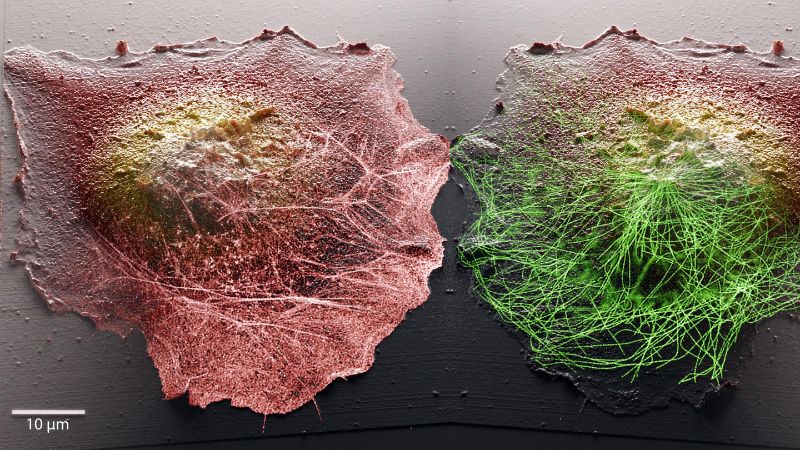
Bildgebungsmethode ermöglicht Live-Einblicke in Zellen
Zellen sind der grundlegende Bestandteil lebender Organismen und beherbergen eine Reihe komplexer biologischer Phänomene. Forschende müssen in der Lage sein, diese Phänomene im Detail zu untersuchen, um bestimmte Arten von Störungen und Krankheiten zu verstehen und dann wirksame Behandlungen zu entwickeln. Die effektive Beobachtung lebender Zellen auf der Mikro- oder Nanoskala bleibt jedoch eine Herausforderung. Durch die Kombination von zwei verschiedenen Mikroskopiemethoden haben EPFL-Forschende aus zwei verschiedenen Labors gemeinsam ein System entwickelt, mit dem sich lebende Zellen mit beispielloser Präzision in Aktion beobachten lassen. Ihre Ergebnisse werden in zwei Artikeln veröffentlicht: der eine erschien im Juli in Nature Communications, der andere wurde jetzt in ACS Nano publiziert.
«Die derzeit verfügbaren Methoden stellen viele technische Herausforderungen dar, um lebende Zellen auf einer derartig granularen Ebene zu beobachten», sagt Georg Fantner, Leiter des Labors für Bio- und Nano-Instrumente (LBNI) der EPFL: «Techniken wie die Elektronenmikroskopie ermöglichen eine unübertroffene Auflösung der Zelloberfläche im Nanobereich, aber dafür müssen die Proben unter Vakuum gesetzt und mit Elektronen beschossen werden. Lebende Organismen können diese Art von Behandlung nicht überleben. Eine weitere gängige Methode ist die Fluoreszenzmikroskopie. Sie ermöglicht zwar die Beobachtung von Proben, ohne sie zu zerstören, doch ist es schwierig, eine ausreichende Auflösung zu erzielen, um die dreidimensionale Oberfläche der Zelle aufzulösen. Ausserdem kann die erforderliche Photonendosis die Zellen schädigen».
Die EPFL-Forschenden beschlossen daher, zwei komplementäre Mikroskope zu kombinieren, um die Zelloberfläche und die molekulare Aktivität im Inneren zu beobachten, die für lebende Zellen minimal invasiv sind. Sie koppelten die stochastische optische Fluktuationsmikroskopie (SOFI), mit der gezielt Moleküle und Phänomene im Zellinneren beobachtet werden können, mit der Rastersondenmikroskopie (genauer gesagt der Rasterkonduktanzmikroskopie – SICM). Bei der Rastersondenmikroskopie wird die Zellprobe in der Regel direkt mit einer Sondenspitze berührt, um ihre Oberfläche freizulegen und ihre Topografie abzubilden. Der mechanische Kontakt zwischen der Probe und der Spitze ist jedoch für die Beobachtung lebender Zellen nachteilig, da er den nativen Zustand der Zellen stört. Das EPFL-Team hat deshalb ein Mikroskop entwickelt, bei dem die physische Sonde durch eine Nanopore aus Glas ersetzt wird, die den Ionenfluss misst, um die Zelloberfläche berührungslos zu erfassen.
Es geht um Interaktion
Die Kombination dieser beiden Methoden ebnet den Weg für noch nie dagewesene wissenschaftliche Beobachtungen. Während die Fluoreszenzmikroskopie den Forschenden einen Blick ins Innere einzelner Zellen ermöglicht, können sie mit der Raster-Ionenleitfähigkeitsmikroskopie topographische 3D-Bilder von Zellmembranen erstellen. Das System der EPFL ermöglicht es den Forschenden also, das Innere und das Äussere von Zellen gleichzeitig zu betrachten, was ihnen wertvolle Einblicke in die Zusammenhänge zwischen den Phänomenen gibt, die an diesen beiden Orten gleichzeitig ablaufen.

«Die Membran einer Zelle ist der Ort, an dem sie mit ihrer Umgebung interagiert», sagt Samuel Mendes Leitão, ein Doktorand am LBNI, der das SICM-Mikroskop entwickelt hat. «Hier finden viele biologische Prozesse und morphologische Veränderungen statt, zum Beispiel während einer Zellinfektion. Mit unserem System können Forschende die molekularen Anordnungen innerhalb der Zelle analysieren und herausfinden, wie sie mit der Membrandynamik korrelieren. Ausserdem können wir diese Dynamik jetzt sehr detailliert über Zeiträume von weniger als einer Sekunde bis zu Tagen verfolgen. Eine der grössten Herausforderungen bei der Mikroskopie von lebenden Zellen ist es, über lange Zeiträume hinweg kontinuierlich Bilder auf der Nanoskala zu erstellen, da Zellen sehr empfindlich auf kleine Störungen reagieren.»
Verbesserte Bildqualität
Vytautas Navikas, Doktorand am Laboratory of Nanoscale Biology (LBEN) der EPFL, hat die optischen Komponenten des Systems entwickelt: «Ein weiterer Vorteil der Kombination der beiden Methoden ist, dass sie die Bildqualität unglaublich verbessert. Wir können nun zelluläre Prozesse mit viel höherer Auflösung beobachten.»
Das EPFL-Team ist überzeugt, dass sein System, mit dem sich Phänomene wie Zellmotilität, Differenzierung und Zell-Zell-Kommunikation beobachten lassen, zahlreiche neue Forschungsmöglichkeiten eröffnet. Es könnte in der Infektionsbiologie, der Immunologie und der Neurobiologie von grossem Nutzen sein – Bereiche, in denen es wichtig ist, zu verstehen, wie eine Zelle in Echtzeit auf einen äusseren Reiz reagiert.
Diese Studie ist auch ein gutes Beispiel für die Art von Durchbruch, die entstehen kann, wenn Forschende aus zwei verschiedenen EPFL-Labors in Kontakt kommen und ihr Fachwissen für ein gemeinsames Ziel bündeln.

Von links nach rechts: Samuel Leitao, Doktorierender am LBNI, Aleksandra Radenovic, LBEN Professor, Georg Fantner, LBNI Professor, und Vytautas Navikas, Doktorierender am LBEN. ©A.Herzog / 2021 EPFL