Wie sich Antibiotikaresistenzen in Bakterien-Kolonien ausbreiten
Was auf den ersten Blick aussieht wie Kunstwerke, entstanden unter dem Einfluss einer reichlichen Dosis von psychedelischen Substanzen, sind Mikroskopieaufnahmen von Bakterienkolonien, die auf Zuchtplatten im Labor wachsen. Die schimmernden Farben rühren daher, dass Forschende von der Abteilung Umweltmikrobiologie am Wasserforschungsinstitut Eawag verschiedene Bakterienstämme mit unterschiedlichen Genen für fluoreszierende Proteine ausgestattet haben: So leuchten einige Zellen in Rot, andere dafür in Grün.
Mobile genetische Elemente für die Übertragung von Antibiotikaresistenzen
Hinzu kommt jedoch ein weiteres Gen für ein blau fluoreszierendes Protein, das Yinyin Ma, Josep Ramoneda und Dave Johnson in ein sogenanntes Plasmid integriert haben. Plasmide sind (im Gegensatz zu den viel grösseren Chromosomen) kleine, mobile genetische Elemente, die Bakterien untereinander austauschen können. Plasmide können zum Beispiel Gene enthalten, die die Wirkung von Antibiotika neutralisieren – und den Bakterien somit eine Resistenz gegenüber den sonst tödlichen Wirkstoffen verleihen.
«Plasmide sind der wichtigste Vektor für die Übertragung von Antibiotikaresistenzen zwischen Bakterienzellen», sagt Johnson. Weil die Forschenden in ihren Versuchen das austauschbare Plasmid blau markiert haben, machen sie in ihren Versuchen sichtbar, was sich in der Umwelt völlig unbemerkt abspielt: Erhalten rote Bakterien das Plasmid, erscheinen sie in Magenta. Und grüne Zellen nehmen eine türkise Farbe an, wenn sie von ihrer Nachbarzelle mit einem Plasmid beschenkt werden.
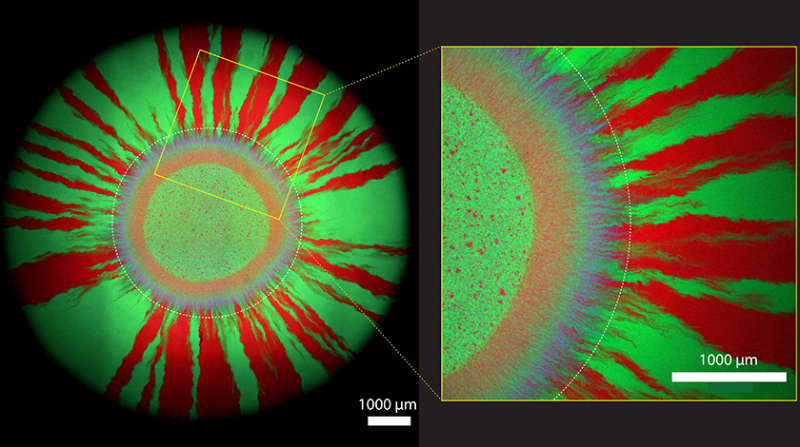
Violetter Kranz umrahmt von roten und grünen Strahlen
Die Gruppe um Johnson interessiert sich dafür, wie sich Antibiotikaresistenzen in wachsenden Bakterienkolonien verbreiten. Für ihre Versuche haben die Forschenden winzige Tropfen eines Gemischs von Bakterien in Magenta und grünen Mikroben auf antibiotikafreie Zuchtplatten aufgetragen. «Bakterienkolonien wachsen am äussersten Rand immer weiter nach aussen», sagt Johnson. Wie sich auf ihren Mikroskopieaufnahmen zeigt, die die Forschenden eine Woche nach dem Anlegen ihrer bakteriellen Kulturen angefertigt haben, formt sich zuerst ein violetter Kranz (aus Zellen in Magenta und Türkis) um den winzigen Tropfen. In dieser ersten Wachstumszone tauschen die Bakterien das Plasmid am intensivsten untereinander aus.
Später – also weiter aussen – bildet sich ein Muster aus grünen und roten Strahlen. Hier haben die Zellen das Plasmid schon verloren. Denn Zellen ohne Plasmid können sich rascher teilen: Sie sparen die Energie ein, die Zellen mit dem Plasmid brauchen, um das zusätzliche genetische Element zu vervielfachen. In anderen Worten: Sie haben einen evolutionären Vorteil – und machen deshalb das Rennen, wenn kein Antibiotika auf der Zuchtplatte zu finden ist.
Doch auf anderen Zuchtplatten haben die Forschenden um Johnson ein Antibiotikum aufgetragen – und zwar zu jeweils unterschiedlichen Zeitpunkten. Die völlig verschiedenen farbigen Muster legen nahe, dass das Plasmid am meisten übertragen wird, wenn das Antibiotikum in einem Zeitraum zwischen 10 und 70 Stunden nach Wachstumsbeginn verabreicht wird. Am besten wirkt das Antibiotikum also offenbar gleich zu Beginn – oder aber deutlich später, wenn schon viele Zellen ihr Plasmid verloren haben.
Zunehmende weltweite Bedeutung
Kann man aus diesen Resultaten auch schliessen, zu welchem Zeitpunkt man menschlichen (oder tierischen) Patienten Antibiotika geben sollte? «Nein», sagt Johnson. Das sei unmöglich, die Versuche im Labor liessen sich nur sehr begrenzt mit dem Antibiotikaeinsatz in der Klinik vergleichen. Denn auf und in uns Menschen und Tieren leben viel mehr als nur zwei verschiedene Bakterienstämme. Das könnte ein Grund sein, wieso Antibiotikaresistenzen auch über Jahre zum Beispiel im Darm erhalten bleiben – und nicht verschwinden wie auf der Zuchtplatte.
Jedenfalls gibt es noch viele offene Fragen zu klären. Johnson hat schon eine Reihe von Ideen, welche Aspekte er mit seiner Gruppe als Nächstes untersuchen möchte. So trägt seine Gruppe Schritt für Schritt zu vertieften Kenntnissen über den genetischen Austausch zwischen Bakterien bei. Dass solche Kenntnisse eine zunehmende weltweite Bedeutung haben, ist den Forschenden bewusst: «Wir sind der Meinung, dass ein besseres zeitliches Verständnis des Zusammenspiels zwischen Plasmidübertragung und Plasmidverlust in komplexen mikrobiellen Gemeinschaften unerlässlich ist, um die globale Antibiotikaresistenz-Krise besser in den Griff zu bekommen», halten sie am Schluss ihres kürzlich erschienenen Fachbeitrags fest.