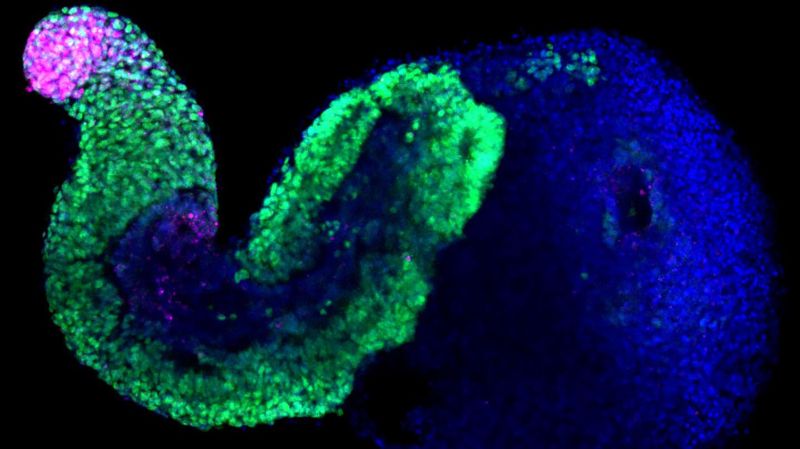
Embryonen geben Aufschluss über einen komplexen genetischen Mechanismus
Ungelöste Fälle sind nicht nur die Domäne der Kriminologie. Auch in der Wissenschaft gibt es ungelöste Rätsel, die in einer Schublade verschlossen sind und auf neue Beweise warten. Und so wie das Aufkommen des DNA-Fingerabdrucks dazu beigetragen hat, alte Kriminalfälle zu lösen, geben neue Zellmodelle den Wissenschaftlerinnen und Wissenschaftlern die Möglichkeit, Forschungsfragen neu zu beantworten, die mit Tiermodellen allein nicht beantwortet werden konnten.
Prof. Denis Duboule, Leiter des Labors für Entwicklungsgenomik der EPFL und Professor am Collège France in Paris, kennt sich mit diesem Thema bestens aus. Seit über 30 Jahren untersucht er das Genom der Maus, um die grundlegenden Mechanismen zu verstehen, die die Entwicklung von Säugetieren steuern. Er ist begeistert von den Möglichkeiten, die «Pseudo-Embryonen», auch Embryoide genannt, bieten. Da diese Zellmodelle, die in vitro aus Stammzellen gezüchtet werden, ähnlich strukturiert sind und sich ähnlich wie Embryonen entwickeln, sind sie sehr vielversprechend, um unser Verständnis der Embryogenese, also des Prozesses der Embryonalentwicklung, zu verbessern. Am 15. Juni veröffentlichte ein Team aus dem Labor von Duboule einen Artikel in Nature Genetics. Darin werden die Ergebnisse der ersten Studie in Duboules Laufbahn vorgestellt, die ohne die Verwendung eines Tiermodells durchgeführt wurde.
Die innere Uhr, die die Entwicklung des Embryos steuert
Der frühe Säugetierembryo entwickelt sich entlang der anterior-posterioren Achse: Der Kopf entwickelt sich zuerst, gefolgt vom Rest des Körpers in «Stadien», die sich entlang der Achse zum Schwanz hin entwickeln. Beim Menschen entwickelt sich alle fünf Stunden ein neues Stadium, bei Mäusen verkürzt sich diese Zeit auf 90 Minuten. Die Forschenden im Labor von Duboule versuchen seit langem zu verstehen, wie die Hox-Gene, die jedem dieser Stadien (z. B. einem Halswirbel oder dem entstehenden Schwanz bei Mäusen) eine Identität verleihen, nach einem genauen Zeitplan über eine innere Uhr aktiviert werden.
«Wir haben uns immer gefragt, wie sich ein Mechanismus, der linearen DNA-Strängen ein derartiges Zeitsystem aufzwingt, auf natürliche Weise entwickelt haben könnte», sagt Duboule, «er funktioniert wie ein Transistor, der bei Mäusen alle 90 Minuten ein Signal abgibt. Wir haben 25 Jahre lang versucht, dieses Phänomen anhand von Tiermodellen zu verstehen.» Das Problem ist, dass dieser Mechanismus erst nach der Einnistung des Embryos in die Gebärmutterwand in Gang kommt, was es den Forschenden besonders schwer macht, ihn zu beobachten. «In diesem Stadium ist der Embryo so klein, dass wir ihn noch nicht in der Gebärmutter lokalisieren können», so Duboule, «wir hatten nie wirklich einheitliches Material gefunden, in dem wir beobachten konnten, was passiert.»
Das änderte sich vor einem Jahrzehnt mit dem Auftauchen von Embryoiden – Zellstrukturen, denen die notwendigen Merkmale fehlen, um sich zu einem ausgewachsenen lebenden Organismus zu entwickeln. Hocine Rekaik, ein Forscher in Duboules Labor und Hauptautor der letzte Woche veröffentlichten Arbeit, nahm Embryoide und reicherte sie an, um den Teil der Struktur zu erhalten, der diese «Stadien» herstellt. Duboule erklärt: «Auf einem DNA-Abschnitt wirkt das CTCF-Protein als eine Art Blocker und verzögert die Expression des dahinter liegenden Hox-Gens. Der Druck, der das Aktivierungssignal auslöst, kommt von Cohesin, einem Proteinkomplex. Hocine entwickelte Animationen, in denen dieser Prozess im Chromatin (der Struktur, die die DNA enthält) zu sehen ist – was bei einem echten Embryo kaum möglich ist, da das System im Laufe der Zeit immer komplexer und ungeordneter wird. Aber die Zellen in diesen Embryonen sind stark im hinteren Teil konzentriert, so dass alles viel einheitlicher ist. Das bedeutet, dass wir den Mechanismus beobachten können, wie er abläuft.»
Vielversprechende neue Methoden
Duboule ist besonders zufrieden mit dem neuen Modell, das sein Team entwickelt hat – nicht nur, weil es vielversprechend für die künftige Forschung ist, sondern auch, weil es relativ schnell und einfach zu handhaben und billiger ist als entsprechende Tiermodelle. Er ist auch erleichtert, eine echte Alternative zu Mäusen gefunden zu haben: «Wir haben in meinem Labor viele Tiere verwendet, daher bin ich sehr froh über das Aufkommen alternativer Modelle, nun da ich mich dem Ende meiner Karriere nähere», sagt er: «Ich glaube nicht, dass wir schon so weit sind, dass wir in der reinen Forschung ganz auf Tiere verzichten können, aber in einigen Bereichen kommen vielversprechende neue Methoden zum Einsatz. Wir treten in eine neue Ära ein, in der wir biologische In-vitro-Modelle herstellen können, die so realistisch sind, dass wir in einigen Fällen nicht unbedingt auf Tiere zurückgreifen müssen. Ich denke, dass mittelfristig ein Grossteil der Grundlagenforschung ohne Tiermodelle stattfinden wird.»
An der EPFL setzen die Forschungsgruppen zunehmend auf so genannte alternative Methoden wie Organoide – aus Stammzellen gezüchtete multizelluläre Mikrogewebe, die die Struktur und Funktion einiger menschlicher Organe nachahmen. Diese Methoden revolutionieren die Grundlagenforschung, die darauf abzielt, ein genaues Bild davon zu gewinnen, wie bestimmte Mechanismen funktionieren. In der Forschung zur Entwicklung von Arzneimitteln, wo die Wissenschaft verstehen will, wie ein Molekül auf ein bestimmtes System wirkt, sind sie jedoch weniger nützlich. In solchen Fällen spielen Tiermodelle nach wie vor eine unverzichtbare Rolle.