Une protéine à l'origine de la résistance à l'immunothérapie
L’immunothérapie est une approche de pointe du traitement contre le cancer. Elle consiste à retourner le système immunitaire de la patiente ou du patient contre sa tumeur. Notre connaissance accrue des mécanismes par lesquels l’organisme régule les réponses immunitaires a ainsi transformé notre combat contre le cancer.
Malgré son taux de réussite, l’immunothérapie s’est toujours heurtée à un obstacle tenace: les cellules tumorales échappent souvent à la «vigilance» des cellules immunitaires qui cherchent à les détruire. Cela entraîne une résistance aux traitements. Mieux comprendre les mécanismes permettant de la contourner est donc nécessaire.
Une récente étude menée par des scientifiques de l’EPFL a mis en lumière une protéine jouant un rôle clé en permettant aux tumeurs d’échapper à la destruction immunitaire. Cette protéine, appelée «protéine du retard mental de l’X fragile» ou FMRP, régule un ensemble de gènes et de cellules dans le microenvironnement tumoral qui lui permet de ne pas être «détectée» par les cellules immunitaires. Dans les neurones, la FMRP est impliquée dans la régulation de la traduction des protéines et la stabilité de l’ARNm. Mais les chercheuses et chercheurs ont découvert qu’elle pouvait être aussi dérégulée dans de nombreux types de cancer.
Publiée dans la revue Science, cette étude a été menée par des scientifiques de l’équipe de Douglas Hanahan de l’Institut Suisse de Recherche Expérimentale sur le Cancer (ISREC) et la branche de Lausanne de l’Institut Ludwig pour la recherche sur le cancer, ainsi que des collègues du Centre hospitalier universitaire vaudois (CHUV) et d’autres institutions suisses. Les découvertes ont également abouti à la création d’une spin-off de l’EPFL, Opna Bio, dont le personnel est également impliqué dans les recherches.
Mais pourquoi s’intéresser à FMRP? L’idée est née de précédentes études montrant que les cellules cancéreuses surexprimant naturellement FMRP sont plus invasives et et ont une plus grande propension à développer des métastases. D’autres études révèlent que si, au contraire, FMRP n’est pas exprimée dans les neurones en développement, cela peut entraîner des déficiences cognitives (d’où la mention «retard mental» contenue dans le nom de la protéine).
Sur la base de ces éléments, les chercheurs ont entrepris d’étudier l’expression de FMRP dans les tumeurs humaines. Ils ont ensuite évalué ses fonctions pro-tumorales dans des modèles murins de cancer. Enfin, ils ont étudié son association avec le pronostic des patientes et patients humains atteints de cancer.
L’étude a comporté plusieurs étapes de collecte de données. Les scientifiques ont d’abord réalisé l’immunomarquage de FMRP sur des tissus provenant de tumeurs humaines. La plupart des tumeurs se sont révélées positives, contrairement aux tissus sains correspondants. Autrement dit, FMRP est spécifiquement et fortement exprimée dans les cellules cancéreuses.
L’équipe est ensuite passée à la partie principale de ses recherches, à savoir déterminer le rôle de FMRP dans ces tumeurs qui expriment la protéine. En effet, à quoi sert-elle?
La protéine FMRP est impliquée dans le système immunitaire
Afin d’étudier ses fonctions, les scientifiques ont développé des lignées de cellules cancéreuses dites «knock-out». Les cellules ou les organismes knock-out sont génétiquement modifiés pour perdre – «inactiver» – un gène spécifique afin de trouver des indices sur sa fonction. En effet, tout changement survenant dans les cellules knock-out par rapport aux cellules qui possèdent encore le gène «de type sauvage» peut généralement être attribué au gène manquant.
Dans ce cas, les scientifiques ont utilisé la célèbre technique d’édition du génome CRISPR-Cas9 pour inactiver le gène (appelé FMR1) qui produit la protéine FMRP dans les cellules cancéreuses de souris provenant du pancréas, du côlon, du sein et des mélanocytes de la peau. Ils ont ensuite comparé les cellules cancéreuses dépourvues de FMRP aux cellules cancéreuses qui possédaient encore le gène FMR1 et exprimaient donc la protéine FMRP.
Les chercheurs ont comparer les taux de survie entre les souris avec des tumeurs renfermant des cellules cancéreuses dépourvues de FMRP et celles avec des cellules FMRP de type sauvage, tout d’abord chez les souris dont le système immunitaire avait été compromis. La comparaison a révélé des taux de survie similaires. En revanche, lorsqu’ils ont comparé les tumeurs knock-out aux tumeurs de type sauvage se développant chez les souris ayant un système immunitaire compétent, ils ont constaté que les tumeurs sans FMRP se développaient plus lentement et que les souris survivaient plus longtemps.
Cela mettant en évidence que la FMRP n’est pas impliquée dans la stimulation de la croissance tumorale en tant que telle, mais qu’elle implique plutôt le système immunitaire adaptatif (la partie de notre système immunitaire que nous «entraînons» grâceaux vaccins par exemple).
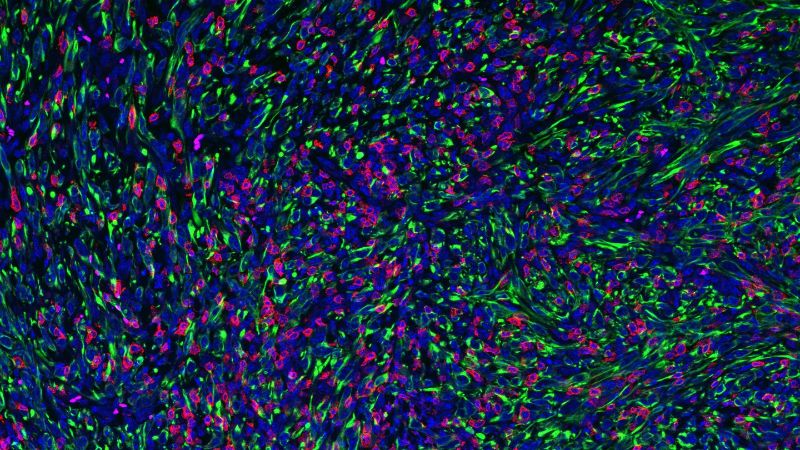
Cette découverte a été confirmée après que les scientifiques aientaient observé que les tumeurs de type sauvage étaient très peu infiltrées par des lymphocytes T, alors que les tumeurs knock-out étaient très enflammées. L’élimination des lymphocytes T des tumeurs dépourvues de FMRP a accéléré leur croissance et réduit le taux de survie des souris, ce qui signifie que FMRP est impliquée dans les mécanismes d’évasion des tumeurs au système immunitaire.
Comment les tumeurs avec la FMRP se défendent contre les cellules immunitaires
L’équipe a poursuivi avec le profilage génétique moléculaire des tumeurs knock-out et de type sauvage révélant d’importantes différences de transcription des gènes sur l’ensemble du génome, ce qui suggère que FMRP interagit avec plusieurs gènes. De plus, les tumeurs présentaient des différences marquées en termes d’abondance de cellules cancéreuses, de macrophages et de lymphocytes T, confirmant ainsi le rôle de la protéine FMRP dans la modulation des composants du système immunitaire.
La phase suivante de l’étude a porté sur la production de facteurs spécifiques associés à des réponses immunitaires distinctes: évasion ou attaque. Il a été observé que les tumeurs exprimant FMRP produisaient ainsi de l’interleukine-33, une protéine sécrétée induisant la production de cellules T régulatrices, une sous-population spécialisée de cellules T qui inhibe les réponses immunitaires. Elles produisent également la protéine S, une glycoprotéine connue pour favoriser la croissance des tumeurs. Enfin, les tumeurs produisent des exosomes – des organites cellulaires qui se sont avérés déclencher la production d’un type de cellule, les macrophages, qui contribue normalement à la cicatrisation et à la réparation des tissus. Ces trois facteurs réunis sont immunosuppresseurs et forment ainsi une barrière protégeant la tumeur contre les attaques des lymphocytes T.
En revanche, les cellules tumorales dépourvues de FMRP répriment ces trois facteurs (interleukine-33, protéine S et exosomes), tandis qu’elles régulent à la hausse une chimiokine appelée «ligand de chimiokine à motif C-C 7» (CCL7), qui contribue à recruter et à activer les lymphocytes T. Ce processus est de plus favorisé par l’induction de macrophages immunostimulateurs (et non immunosuppresseurs). Ces cellules produisent également trois autres protéines pro-inflammatoires collaborant avec CCL7 afin de recruter les lymphocytes T.

Crédit: Agnieszka Chryplewicz et Douglas Hanahan
Prédire les résultats de l’immunothérapie chez les patientes et patients humains
En pratique clinique, la question est de savoir si les niveaux de FMRP peuvent aider à établir un pronostic pour les patientes et patients sous immunothérapie. Contre toute attente, l’ARNm du gène FMR1 et les niveaux de la FMRP dans les tumeurs sont insuffisants pour prédire les résultats dans les cohortes de patients atteints de cancer.
Pour y remédier, les chercheurs se sont appuyés sur le fait que, dans la cellule, la FMRP module à la hausse ou à la baisse la stabilité de l’ARNm en s’y liant directement. Autrement dit, la FMRP pourrait modifier les niveaux d’ARN relevés dans les ensembles de données transcriptomiques, lesquels pourraient être collectés afin d’identifier une «signature génétique» permettant de suivre son activité fonctionnelle. Cette approche a fonctionné avec succès, permettant aux scientifiques de définir une signature génétique de l’activité de régulation du cancer de la FMRP avec un ensemble de 156 gènes.
La signature de l’activité de la FMRP dans les cellules cancéreuses s’est avérée associée à un pronostic de survie médiocre dans de nombreux cancers humains. Ce constat est cohérent avec les effets immunosuppresseurs de la protéine FMRP, et, chez certains patients, elle était liée à de faibles taux de réponse aux traitements par immunothérapie.
Ces travaux montrent que la FMRP régule un ensemble de gènes et de cellules dans le microenvironnement tumoral aidant les tumeurs à échapper à la destruction immunitaire.
Douglas Hanahan explique: «Si j’étudie la composition cellulaire complexe des tumeurs solides depuis des décennies, je suis très étonné par notre découverte. Une protéine régulatrice neuronale cooptée – FMRP – peut orchestrer la formation d’une barrière protectrice à multiples facettes contre l’attaque du système immunitaire, ce qui, par conséquent, limite limitantl’efficacité des immunothérapies, présentant ainsi la protéine FMRP comme une nouvelle cible thérapeutique dans le cancer.»