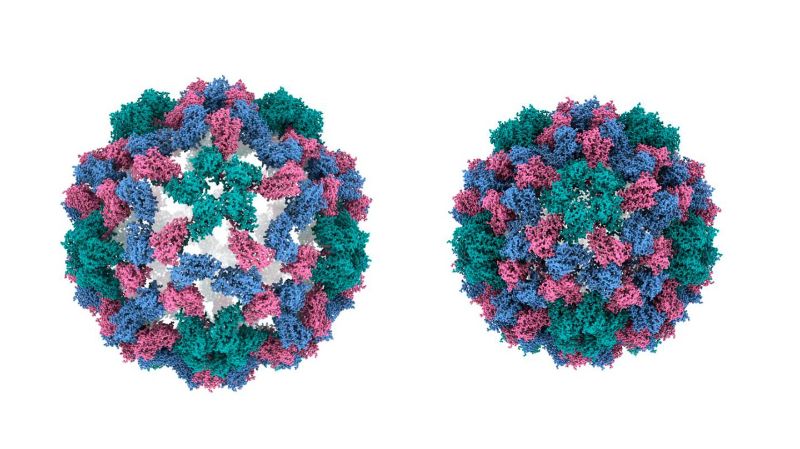Une nouvelle technique d'imagerie révèle les secrets des virus
Les protéines sont des éléments indispensables des systèmes biologiques. Elles effectuent leur travail avec une précision et une rapidité extraordinaires. Pendant des années, l’observation des protéines a constitué un défi de taille, car les techniques d’imagerie manquaient souvent de rapidité et de résolution pour capturer leurs danses élégantes au rythme soutenu.
Sous la houlette du professeur Ulrich Lorenz de l’EPFL, une équipe de scientifiques a utilisé une nouvelle technique d’imagerie qui pousse la résolution temporelle de la cryomicroscopie électronique (cryo-EM) jusqu’à la microseconde, pour observer en temps réel la dynamique rapide d’un virus. L’étude est publiée dans Nature Communications.
Les chercheuses et chercheurs ont développé la technique d’imagerie pour la première fois en 2021, en se basant sur la cryo-EM, une technique qui permet de capturer des images de biomolécules telles que les protéines avec une précision atomique. En cryo-EM, les échantillons sont placés dans de la glace vitreuse, une forme de glace ressemblant à du verre qui est obtenue lorsque l’eau est gelée si rapidement que la cristallisation ne peut pas se produire. Une fois l’échantillon vitrifié, des images haute résolution de sa structure moléculaire peuvent être prises avec un microscope électronique, un instrument qui forme des images à l’aide d’un faisceau d’électrons à la place de la lumière.
La technique de cryo-EM innovante a permis à ses inventeurs, Jacques Dubochet, Joachim Frank et Richard Henderson, de décrocher le prix Nobel de chimie en 2017. En 2021, Ulrich Lorenz et son laboratoire ont élargi les capacités de la cryo-EM, afin de capturer des images des mouvements des protéines à l’échelle de la microseconde (un millionième de seconde) en faisant fondre rapidement l’échantillon vitrifié à l’aide d’une impulsion laser. Lorsque la glace devient liquide, il y a une fenêtre de temps modulable dans laquelle la protéine peut être incitée à se mouvoir de la même manière que dans son état liquide naturel dans la cellule.
En adoptant la même approche, les chercheuses et chercheurs ont aujourd’hui utilisé leur technique pour capturer les mouvements rapides des virus avec une précision sans précédent. L’équipe s’est penchée sur le virus de la marbrure chlorotique du niébé (CCMV), un virus végétal connu pour ses mouvements de grande amplitude, essentiels à son cycle d’infection. On sait qu’un changement de pH provoque une expansion rapide de la capside (enveloppe protectrice) du virus. Grâce à la nouvelle technique, l’équipe a pu observer les mécanismes de ce processus.
«L’expansion de la capside se produit lorsque le virus infecte une cellule, déclare Ulrich Lorenz. Nous avons étudié ce processus en sens inverse, c’est-à-dire la contraction de la capside, ce qui nous a permis de mieux comprendre les mécanismes de la capside.»
La nouvelle technique d’imagerie est miraculeuse. «Nous avons obtenu une image très détaillée du fonctionnement et des mécanismes de cette “machine” à l’échelle nanométrique, avec la découverte surprenante que les différents mouvements des protéines de la capside se produisent à des vitesses différentes, indique Ulrich Lorenz. Nous avons également appris que la contraction, même s’il s’agit d’un mouvement de grande amplitude, est très rapide, le virus en expansion ressemblant à un ressort tendu qui est soudainement relâché et se contracte.»
Au-delà du virus, la nouvelle technique de cryo-EM résolue en temps à l’échelle de la microseconde permet de relever le défi plus vaste de l’observation du fonctionnement des protéines. «Nous montrons, pour la première fois, que notre technique peut être utilisée pour observer un processus qui se produit dans la nature, explique Ulrich Lorenz. Il n’existe aucune autre technique permettant de faire ce type d’observation. S’il s’avère possible d’étendre nos expériences à un vaste ensemble de systèmes, ce dont nous sommes fermement convaincus, notre technique pourrait révolutionner notre compréhension du fonctionnement des protéines.»