Un phénomène génétique complexe mieux compris grâce aux embryoïdes
En science aussi, il existe des cold cases, des affaires non résolues et archivées dans l’attente de l’apparition de nouveaux éléments prometteurs. Tout comme les méthodes d’analyse des empreintes génétiques permettent aujourd’hui de résoudre d’anciens crimes, l’apparition de nouveaux modèles cellulaires offre aux scientifiques la possibilité de revisiter des questions de recherche qui avaient trouvé leurs limites chez l’animal.
À l’EPFL, le Professeur Denis Duboule (également profeseur au Collège de France, à Paris) en sait quelque chose. Lui qui travaille depuis plus de 30 ans sur le génome de souris pour comprendre les mécanismes fondamentaux de l’évolution des mammifères, a vu comme une chance incroyable l’apparition des «pseudo-embryons» ou embryoïdes, ces structures cellulaires cultivées à partir de cellules souches, présentant des caractéristiques similaires à celles d'un embryon en termes de composition et de développement et très utiles pour comprendre l’embryogénèse. A tel point que son Laboratoire de Génomique du Développement a publié, le 15 juin dans Nature Genetics, la première étude de sa carrière à l’EPFL n’ayant pas eu recours au modèle animal.
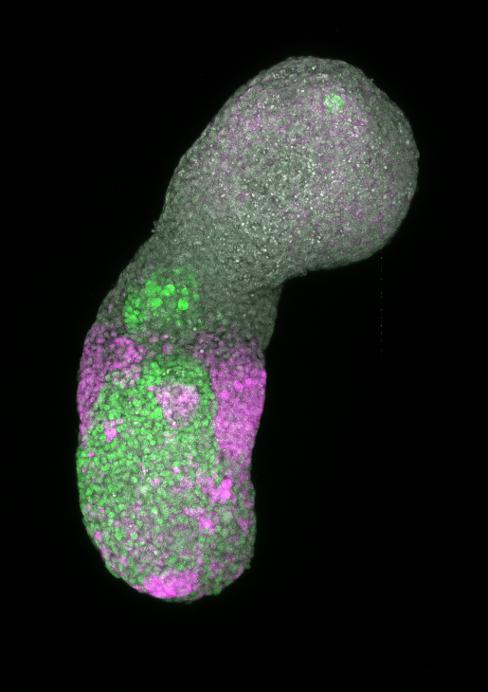
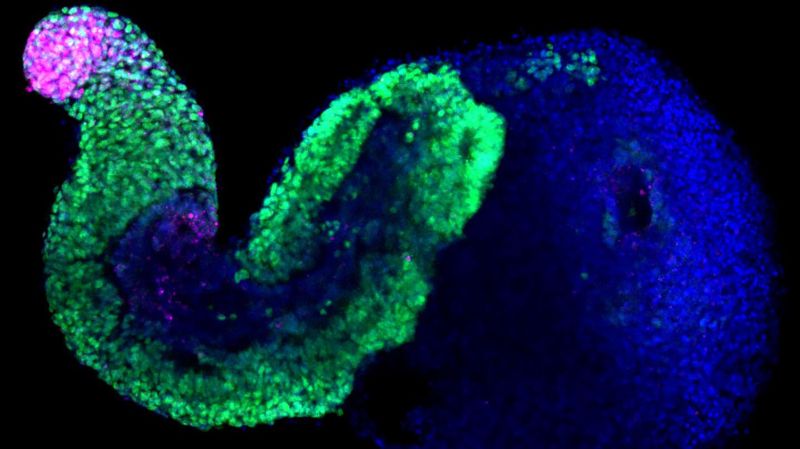
Les embryoïdes sont des structures cellulaires cultivées à partir de cellules souches, présentant des caractéristiques similaires à celles d'un embryon. © Alexandre Meyran, EPFL
Une horloge interne chez l’embryon
Une petite mise en contexte s’impose: le corps des mammifères est fabriqué au stade embryonnaire dans une temporalité antéro-postérieure: d’abord la tête, puis le reste du corps, par «étages» du haut vers le bas, avec une partie toutes les 5h chez l’humain et toutes les 90 minutes chez la souris. Le laboratoire de Denis Duboule cherche depuis longtemps à comprendre comment les gènes architectes Hox, qui permettent de donner une identité à ces «étages» (par exemple, une vertèbre cervicale, ou le début de la queue chez la souris) peuvent être activés selon une temporalité très précise, via une horloge interne.
«On s’est toujours demandé comment la nature a pu faire évoluer un mécanisme qui utilise la linéarité des brins d’ADN en leur superposant ce système de timing, explique Denis Duboule. C’est comme un transistor, envoyant un signal toutes les 90 minutes chez la souris. Nous avons passé 25 ans à utiliser des animaux pour essayer de comprendre.» Problème: ce mécanisme intervient dans une période du développement extrêmement difficile d’accès aux chercheurs, car suivant l’implantation de l’embryon dans la muqueuse utérine. «C’est tout petit, on ne trouve pas encore les embryons dans l’utérus à ce stade, donc on n’a jamais vraiment pu trouver de matériels homogènes pour voir ce qui se passait.»
Cela, jusqu’à l’émergence, il y a une dizaine d’années, de ces fameux embryoïdes qui, notons-le, ne possèdent pas les caractéristiques nécessaires pour se développer en un organisme complet et donc vivant. Hocine Rekaik, chercheur au laboratoire de Denis Duboule et premier auteur de l’étude parue la semaine dernière, a pu les utiliser et les enrichir pour obtenir la partie cellulaire qui fabrique ces «étages», un modèle très simplifié mais proche de la réalité. «Sur l’ADN, la protéine CTCF, qui est une sorte de bloqueur, va retarder l’activation du gène Hox situé derrière. Et la pression qui initie le message d’activation se fait par un complexe de protéines, les cohésines. Hocine a pu faire des animations où on voit cela, au niveau de la chromatine (la structure qui contient l’ADN), ce qui est généralement impossible puisque dans un vrai embryon, avec le temps, le système est de plus en plus complexe et hétérogène. Dans ces embryoides, les cellules sont tellement concentrées sur la partie postérieure que c’est beaucoup plus homogène. On peut y voir la dynamique du mécanisme», continue Denis Duboule.
Méthodes prometteuses
Le professeur, qui se félicite de la mise au point d’un modèle extrêmement utile pour ses recherches, relativement simple et rapide à utiliser et meilleur marché que le modèle animal, confie son soulagement d’avoir réussi à se passer des souris. «Nous avons utilisé beaucoup d’animaux dans mon laboratoire, et je suis très content de terminer ma carrière avec des systèmes alternatifs. Je suis toujours convaincu qu’on ne peut pas se passer dans animaux pour la recherche fondamentale, mais il y a certains domaines où des méthodes prometteuses sont en train de se développer. Nous entrons dans une nouvelle ère dans laquelle il est possible de reproduire in vitro des situations biologiques si proches de la réalité qu’il ne sera pas forcément nécessaire, dans certains cas, de revenir à l’animal. Beaucoup de groupes de recherche fondamentaux pourront à moyen terme, à mon avis, se passer d’animaux».
Les méthodes dites alternatives, comme les organoïdes, ces micro-tissus multicellulaires dérivés de cellules souches et conçus pour imiter la structure et la fonctionnalité de certains organes humains, sont de plus en plus utilisées par de nombreux groupes de recherche à l’EPFL. Révolutionnaires en recherche fondamentale, pour des questions très précises de compréhensions de mécanismes, ils atteignent leurs limites lorsque les scientifiques tentent de visualiser l’effet d’une molécule sur le système, dans le cadre du développement de thérapies par exemple, pour lequel le modèle animal reste toujours indispensable.