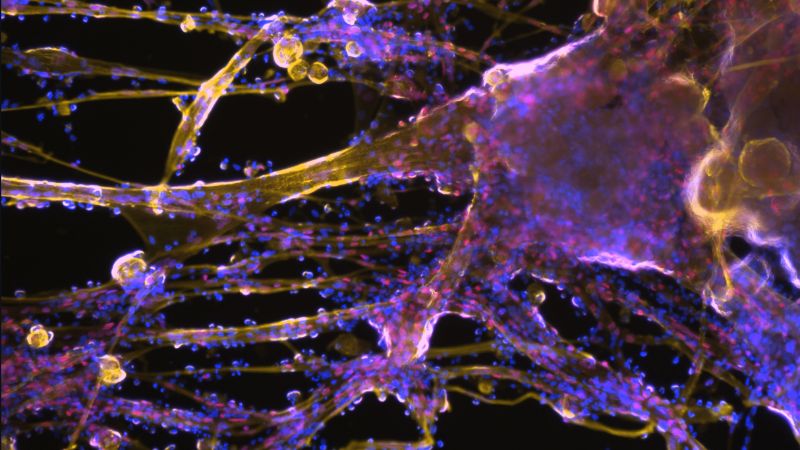
Du muscle en laboratoire
En bref
- Les cellules du tissu conjonctif peuvent désormais être transformées en cellules souches musculaires sans génie génétique.
- Cette approche pourrait s'avérer pertinente pour des applications thérapeutiques chez les patients et patientes souffrant de maladies musculaires.
- Pour développer cette nouvelle méthode, l'équipe de recherche s'est inspirée des vaccins à ARNm pour le COVID-19.
Le professeur Ori Bar-Nur de l'ETH Zurich et son équipe cultivent des cellules musculaires en laboratoire. Dans le cas présent, il s'agit de cellules de souris, mais les scientifiques s'intéressent également aux cellules humaines et aux cellules de vache. Des applications prometteuses sont envisagées : le tissu musculaire humain cultivé en laboratoire pourrait être utilisé en chirurgie, tandis que les cellules souches musculaires humaines pourraient aider les personnes souffrant de maladies musculaires ; quant au tissu musculaire de vache cultivé en laboratoire, il pourrait révolutionner l'industrie de la viande en permettant la production de viande sans qu'il soit nécessaire d'abattre des animaux.
Pour l'instant, les recherches de l'équipe de l'ETH Zurich se concentrent sur l'optimisation et la sécurisation de la production de cellules souches musculaires. Ils et elles y sont parvenues grâce à une nouvelle approche.
Cellules reprogrammées
Comme d'autres chercheuses et chercheurs dans ce domaine, les scientifiques de l'ETH Zurich utilisent un type de cellule différent, plus facile à cultiver, comme matériau de départ pour générer des cellules musculaires : les cellules du tissu conjonctif. À l'aide d'un cocktail de petites molécules et de protéines, ils et elles reprogramment moléculairement ces cellules, les convertissant ainsi en cellules souches musculaires, qui se multiplient ensuite rapidement et produisent des fibres musculaires. «Cette approche nous a permis de produire de grandes quantités de cellules musculaires», explique Xhem Qabrati, doctorant dans le groupe de Bar-Nur et l'un des deux principaux coauteurs de cette étude. «Bien que les cellules musculaires puissent également être cultivées directement à partir de biopsies musculaires, les cellules ont tendance à perdre leur fonctionnalité après l'isolement, ce qui rend difficile la production de grandes quantités de cellules.»
Un composant important du cocktail utilisé - et un catalyseur central de la transformation cellulaire - est la protéine MyoD. Il s'agit d'un facteur de transcription qui régule l'activité de certains gènes musculaires dans le noyau cellulaire. MyoD n'est normalement pas présente dans les cellules du tissu conjonctif. Avant que ces cellules ne se transforment en cellules musculaires, les scientifiques doivent les inciter à produire MyoD dans leur noyau pendant plusieurs jours.
Pas de génie génétique
Jusqu'à présent, les scientifiques avaient recours au génie génétique pour ce processus : Ils et elles utilisaient des particules virales pour transporter le plan d'ADN de la protéine MyoD dans le noyau de la cellule. Là, les virus insèrent ces instructions de construction dans le génome, ce qui permet aux cellules de produire la protéine MyoD. Cette approche comporte toutefois un risque pour la sécurité : on ne peut pas contrôler l'endroit exact du génome où les virus insèrent ces instructions. Il arrive que les virus s'intègrent au milieu d'un gène vital, l'endommageant, ou que ce processus d'insertion entraîne des changements susceptibles de déclencher la formation de cellules cancéreuses.
Cette fois, Ori Bar-Nur et ses collègues ont utilisé une approche différente pour délivrer MyoD aux cellules du tissu conjonctif, inspirée des vaccins ARNm pour le COVID-19 : au lieu d'utiliser des virus pour introduire le plan d'ADN du gène MyoD, ils et elles ont introduit la transcription ARNm de ce gène dans les cellules. Comme le génome de la cellule reste inchangé, les conséquences négatives associées à de telles modifications sont évitées. L'ARNm permet toujours aux cellules du tissu conjonctif de produire la protéine MyoD, de sorte qu'avec les autres composants du cocktail optimisé par les chercheuses et chercheurs de l'ETH Zurich, elles peuvent se transformer en cellules souches et en fibres musculaires.
Les chercheurs et chercheuses ont récemment publié leur nouvelle approche dans la revue NPJ Regenerative Medicine. Elles et ils sont les premiers à reprogrammer des cellules du tissu conjonctif en cellules souches musculaires sans génie génétique.
Aide à la distrophie musculaire
Les cellules musculaires ainsi produites sont également pleinement fonctionnelles, comme l'ont montré les scientifiques lors d'expériences sur des souris atteintes de la dystrophie musculaire de Duchenne. Chez l'être humain, cette maladie héréditaire rare prive les malades d'une protéine nécessaire à la stabilité des muscles, ce qui entraîne une fonte musculaire et une paralysie progressives.
Les scientifiques de l'ETH Zurich ont injecté des cellules souches musculaires non défectueuses dans les muscles de souris atteintes de la dystrophie musculaire de Duchenne et porteuses de ce défaut. Ils et elles ont pu montrer que les cellules souches saines forment des fibres musculaires réparées dans les muscles. «Une telle transplantation de cellules souches musculaires pourrait être particulièrement utile pour les patientes et patients atteints de la forme avancée de la dystrophie musculaire de Duchenne, qui sont déjà gravement touchés par l'atrophie musculaire», explique Inseon Kim, une autre doctorante du groupe Bar-Nur et l'une des principales co-auteures de l'étude. La méthode permet de produire de grandes quantités de cellules souches musculaires nécessaires à cet effet. De plus, le fait qu'elle se passe du génie génétique et des risques qui y sont associés la rend attrayante pour une éventuelle utilisation thérapeutique future chez l'être humain.
Production de viande alternative
Cependant, les scientifiques doivent encore adapter leur approche aux cellules humaines, ce qui constitue leur prochaine étape. «En outre, nous souhaitons étudier s'il est également possible de convertir des cellules du tissu conjonctif en cellules musculaires directement dans le corps en injectant l'ARNm de MyoD et les autres composants du cocktail à des souris souffrant de maladies musculaires», explique Ori Bar-Nur. Cette approche pourrait également aider un jour les patients et patientes humaines.
Enfin, Ori Bar-Nur et son équipe aimeraient intégrer leurs nouvelles découvertes dans leurs travaux en cours sur les cellules de vache, un autre axe de recherche du laboratoire. Ils et elles espèrent que cette méthode contribuera aux efforts actuels de culture de cellules souches musculaires animales pour la production de viande cultivée, une méthode alternative de production de viande destinée à la consommation.