Comment le microbiote humain résiste à la bactérie du choléra
Le choléra est une maladie diarrhéique aiguë qui reste encore un fléau. On recense sept grandes pandémies de choléra au cours des deux cents dernières années. Selon l’OMS, le choléra tue encore jusqu’à 143 000 personnes chaque année et en infecte jusqu’à 4 millions, principalement dans les pays pauvres ou sous-développés.
Le choléra est causé par la bactérie Vibrio cholerae, un agent pathogène d’origine hydrique qui infecte l’intestin humain après l’ingestion d’une eau contaminée. Vibrio cholerae commence alors à coloniser la surface interne de l’intestin et libère une toxine sur les cellules épithéliales. Cette toxine perturbe l’équilibre ionique des parois de l’intestin, provoquant l’excrétion d’une diarrhée aqueuse. Dans les cas graves, le choléra peut entraîner la mort en raison d’une déshydratation sévère.
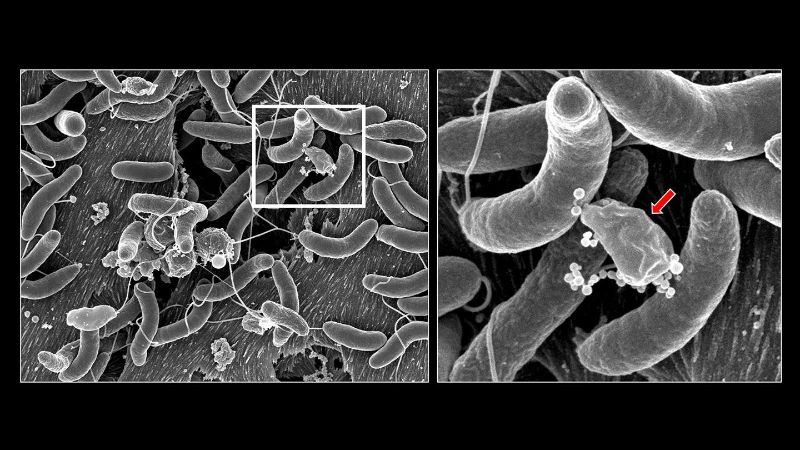
Mais les manifestations du V. cholerae ne s’arrêtent pas là. En 2015, des chercheurs dirigés par le professeur Melanie Blokesch de l’EPFL ont publié un article fondamental montrant que la bactérie utilise une lance à ressort pour perforer les bactéries environnantes et subtiliser leur ADN alors qu’elle se développe dans son environnement. Cette lance moléculaire appelée «système de sécrétion de type VI» ou T6SS a auparavant été décrite comme favorisant la concurrence interbactérienne. «L’eau contaminée dans les régions du monde où le choléra est endémique contiendrait la bactérie V. cholerae avec le T6SS actif et prêt à la concurrence», explique Melanie Blokesch.
Des pièces de puzzle manquantes
Selon de précédentes études, les agents pathogènes intestinaux doivent interagir avec les bactéries du microbiome intestinal pour s’établir dans cet environnement. Pour cela, ils utilisent diverses stratégies, allant de la concurrence pour les nutriments à la lutte bactérienne totale. Plusieurs études ont révélé que les agents pathogènes intestinaux utilisent leur lance T6SS pour nettoyer la niche intestinale et favoriser leur propre installation.
L’interaction de la bactérie V. cholerae avec le microbiome intestinal est un phénomène difficile à étudier. En temps normal, les scientifiques développeraient un modèle animal adulte standardisé, mais la bactérie V. cholerae est connue pour coloniser relativement mal les animaux adultes par rapport aux êtres humains. Les chercheurs doivent donc recourir à de jeunes animaux, mais ceux-ci ne disposent pas du microbiome mature avec lequel la bactérie V. cholerae interagit dès qu’elle commence à coloniser l’intestin.
Parallèlement, de nombreuses études ont montré que la résistance à la colonisation par V. cholerae et d’autres bactéries infectieuses dépend en grande partie des microbes dits «commensaux» présents dans l’intestin. Les microbes commensaux, et en particulier ceux de l’intestin humain, n’ont pas beaucoup été étudiés en termes d’interaction avec V. cholerae.
Résistance des intestins
Dans un article publié dans Nature Communications, le groupe de Blokesch a étudié la manière dont V. cholerae interagit avec les bactéries du microbiote humain. Les scientifiques ont examiné une petite collection de bactéries commensales provenant de volontaires humains. Celles-ci comprenaient plusieurs espèces bactériennes comme Escherichia coli, Enterobacter cloacae et divers isolats de Klebsiella.
Ils ont constaté que, bien que plusieurs espèces de bactéries intestinales soient épuisées à la suite d’attaques de V. cholerae par le T6SS, un sous-ensemble important y résiste. Plus précisément, certaines espèces intestinales de Klebsiella se protègent contre les attaques du T6SS de V. cholerae grâce à une capsule de polysaccharide caractéristique des bactéries dites «encapsulées».
Le T6SS étant un système de neutralisation très efficace, les bactéries comme V. cholerae qui l’utilisent ont également des moyens de s’en protéger pour éviter l’auto-intoxication. Pour ce faire, les bactéries utilisant le T6SS produisent certaines protéines immunitaires, qui bloquent les effets toxiques du T6SS.
Toutefois, l’étude a révélé que certains membres du microbiote humain se protègent des attaques du T6SS sans passer par la voie immunitaire-protéique. Plus précisément, l’étude a révélé que E. cloacae, un agent pathogène opportuniste, se défend en tuant V. cholerae avec sa propre arme T6SS supérieure.
«Ces travaux nous apportent de nouvelles informations sur le comportement des communautés bactériennes au sein du microbiote intestinal et sur la manière dont la défense contre l’intoxication par le T6SS pourrait aider les populations bactériennes à se défendre contre les agents pathogènes envahissants», explique Melanie Blokesch. Elle souligne également que l’étude a été réalisée in vitro, ce qui signifie que des études supplémentaires sont nécessaires pour obtenir un aperçu plus complet.
«Cela dit, nos travaux pourraient servir de point de départ à la conception rationnelle de souches probiotiques protégées par le T6SS, capables de restaurer les barrières de colonisation défectueuses ou d’en améliorer l’efficacité», concluent les auteurs.
Enfin, Melanie Blokesch souligne la générosité de ses collègues qui ont partagé des souches bactériennes pour cette étude. Elle insiste également sur le fait qu’il aurait été beaucoup plus difficile de s’engager dans de nouvelles voies, notamment la biologie de Klebsiella, sans la formidable collaboration avec Olaya Rendueles et Eduardo Rocha de l’Institut Pasteur de Paris.
«Plus encore que le message scientifique, ce que j’ai le plus apprécié, c’est l’aspect collaboratif (au sein et à l’extérieur du laboratoire)», reconnaît Nicolas Flaugnatti, post-doctorant dans le groupe de Blokesch et principal auteur (partagé) de cette étude.