Les organoïdes transforment la recherche sur infections respiratoires
Les biofilms sont des communautés de bactéries très résistantes qui posent un problème majeur dans le traitement des infections. Alors que l’étude de la formation des biofilms en laboratoire a été menée de manière approfondie, leur développement dans l’environnement complexe des voies respiratoires humaines reste difficile à comprendre.
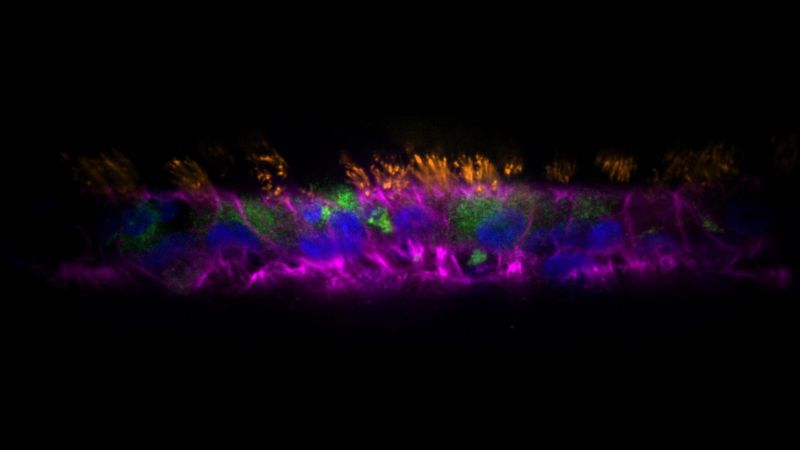
Une équipe composée de chercheuses et chercheurs dirigés par Alexandre Persat de l’EPFL a résolu le problème en développant des organoïdes appelés AirGels. Les organoïdes sont des tissus 3D miniatures et auto-organisés qui sont cultivés à partir de cellules souches pour imiter les tissus et les organes du corps humain. Ils représentent un changement de paradigme dans le domaine, permettant aux scientifiques de reproduire et d’étudier les environnements complexes des organes en laboratoire.
Mis au point par Tamara Rossy et ses collègues, les AirGels sont des modèles de tissus pulmonaires humains conçus par bio-ingénierie qui ouvrent de nouvelles possibilités en matière de recherche sur les infections. Ils révolutionnent la recherche dans ce domaine en reproduisant fidèlement les propriétés physiologiques de la muqueuse des voies respiratoires, notamment la sécrétion de mucus et le battement ciliaire. Grâce à cette technologie, les scientifiques peuvent étudier les infections des voies respiratoires de manière plus réaliste et plus complète, en comblant le fossé entre les études in vitro et les observations cliniques.
Dans cette étude publiée dans la revue PLoS Biology, les chercheuses et chercheurs ont utilisé les AirGels pour étudier le rôle du mucus dans le processus de formation de biofilms par Pseudomonas aeruginosa, une bactérie pathogène généralement résistante aux antibiotiques. En contaminant les AirGels avec P. aeruginosa et en les étudiant au microscope à haute résolution, ils ont pu observer la bactérie former des biofilms en temps réel.
Leurs observations ont révélé que P. aeruginosa induit activement la contraction du mucus de son hôte à l’aide de filaments rétractiles appelés pili de type IV (T4P). Les filaments T4P génèrent les forces nécessaires pour contracter le mucus des voies respiratoires, ce qui permet aux cellules de P. aeruginosa de s’agréger et de former un biofilm. Les chercheuses et chercheurs ont validé leurs résultats par des simulations de suivi et des expériences biophysiques sur des mutants sélectionnés de P. aeruginosa.
Cette étude montre que le modèle organoïde AirGel peut fournir des informations uniques sur les interactions mécaniques entre les bactéries et l’environnement de leurs hôtes. Elle a permis de découvrir un mécanisme inconnu jusqu’ici qui contribue à la formation de biofilms dans les voies respiratoires.
La conception d’organoïdes reproduisant fidèlement l’environnement des muqueuses ouvre de nouvelles voies d’exploration, permettant aux chercheuses et chercheurs de découvrir des aspects méconnus dans le domaine des infections, d’étudier l’influence d’autres facteurs physiologiques, tels que la température, l’humidité, les médicaments et les facteurs de stress chimiques, sur le développement et la progression de l’infection, et de mettre au point des traitements ciblés contre les agents pathogènes résistants aux antibiotiques.