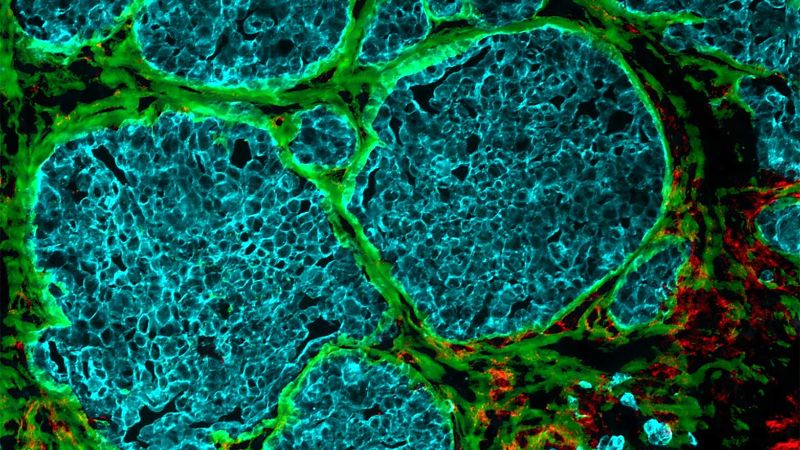
Comment les tumeurs transforment les vaisseaux sanguins
Il y a près de dix ans, des scientifiques ont observé pour la première fois que les tumeurs de différents cancers - notamment le cancer colorectal, le cancer du sein et le mélanome - présentaient des canaux allant de la surface à l'intérieur de l'amas cellulaire. Mais la manière dont ces canaux se forment et les fonctions qu'ils remplissent sont longtemps restées un mystère.
Expériences élaborées et détaillées
Grâce à une série d'expériences élaborées et détaillées, les groupes de recherche dirigés par Viola Vogel, professeure de mécanobiologie appliquée à l'ETH de Zurich, et Gertraud Orend de l'Université de Strasbourg ont trouvé des réponses possibles à ces questions. De nombreux éléments suggèrent que ces canaux, que les chercheuses et chercheurs ont baptisés «voies tumorales», étaient autrefois des vaisseaux sanguins.
Ces vaisseaux sanguins commencent par approvisionner en glucose et en oxygène les amas de cellules à croissance rapide. Mais les vaisseaux subissent ensuite un processus qui les prive de leur fonction initiale de transport du sang : les parois des vaisseaux se modifient et la cavité des vaisseaux se remplit progressivement.
Quand les fibres contrôlent le comportement des cellules immunitaires
Ce matériau de comblement se compose principalement de cellules et de fibres protéiques nouvellement formées, qui constituent ce que l'on appelle la matrice extracellulaire. On y trouve des fibres de collagène et des fibres de fibronectine. Ces dernières jouent un rôle dans les processus de croissance qui ont lieu principalement lors du développement embryonnaire ou de la cicatrisation des plaies. Dans leur article, les chercheurs et chercheuses montrent que les fibres situées dans les traces de la tumeur sont capables de piéger les cellules immunitaires.
Dans ce cas, les cellules immunitaires s'étirent le long des canaux et se collent aux fibres lâches de fibronectine. «Sous cette forme allongée, les cellules immunitaires passent de la lutte contre les maladies au soutien des processus de guérison», explique Viola Vogel. Au lieu d'attaquer les cellules tumorales, elles excrètent des molécules qui stimulent la croissance, aidant ainsi les cellules cancéreuses à se multiplier.
Le rôle jusqu'ici inconnu de la tension tissulaire
Il apparaît clairement que la tension des fibres de la matrice extracellulaire joue un rôle clé et inconnu jusqu'à présent dans le développement des tumeurs : dans les tissus sains, les fibres de fibronectine sont extrêmement tendues ; ce n'est que dans les tissus tumoraux qu'elles sont détendues. Dans cette forme plus lâche, plus détendue, entourée de parois de vaisseaux sanguins transformés, les fibres de fibronectine créent manifestement une cavité dans laquelle les cellules cancéreuses peuvent se développer sans être dérangées.
Selon Viola Vogel, la recherche sur le cancer s'est surtout concentrée sur les cellules : «La matrice extracellulaire a souvent été négligée». C'est pourquoi la diaphonie entre les cellules et leur environnement reste un mystère. «Mais si l'on veut comprendre ce que fait une araignée, il faut aussi regarder sa toile», dit-elle.
Examen d'échantillons de tissus prélevés sur des patientes et patients
C'est pourquoi Viola Vogel voit dans ces nouveaux résultats une raison d'élargir son champ de recherche et d'acquérir une meilleure compréhension de la situation dans son ensemble. «Mieux nous comprendrons comment le microenvironnement oriente la multiplication des cellules tumorales, plus nous aurons de chances de trouver un moyen de l'empêcher», explique-t-elle.
Viola Vogel met toutefois en garde contre la transposition des implications de ces résultats à l'être humain, car ils sont basés sur des expériences menées sur des souris atteintes d'un cancer du sein. Il reste à voir si ces résultats peuvent être appliqués directement aux cancers chez l'être humain. Mais il y a effectivement plusieurs parallèles, comme l'a récemment démontré le groupe de Gertraud Orend.
Entre-temps, le groupe de recherche de Viola Vogel a commencé à collaborer avec le Kantonsspital Baden sur un projet de suivi : l'un des doctorants de Vogel cherche à savoir si les échantillons de tissus prélevés sur des patientes atteintes d'un cancer du sein contiennent également des traces de vaisseaux sanguins transformés. «Nous sommes curieuses et curieux de découvrir où nous trouverons des similitudes et où nous verrons des différences», explique la professeure.