Une protéine modifiée booste les cellules anti-cancéreuses
Contre le cancer, il existe plusieurs traitements, dont l’immunothérapie. Son principe est simple : le système immunitaire du patient, composé de lymphocytes ou cellules T, est stimulé afin que ces cellules T détruisent les cellules cancéreuses. Sans l’immunothérapie les lymphocytes restent inactifs face à la tumeur. Malgré son efficacité approuvée, ce traitement possède un défaut majeur : il ne fonctionne que sur 20 à 30% des patients. Une majorité de patients atteints de cancer ne peuvent bénéficier des immunothérapies actuelles.
Un travail d’équipe
Les scientifiques s’efforcent par tous les moyens d’augmenter ce ratio. À la faculté des sciences et techniques de l’ingénieur, le professeur Li Tang et son équipe du laboratoire de biomatériaux pour l’immunoingénierie ont collaboré avec des chercheurs de six autres laboratoires de différentes universités pour trouver un moyen de rendre l’immunothérapie plus efficace. En tout ce sont près de vingt-deux chercheurs qui ont allié leurs compétences en biologie, immunologie, bioingénierie, bioinformatique, entre autres. Leur étude est publiée dans Nature Immunology.

Professeur Li Tang © Alain Herzog / 2021 EPFL
Booster les cellules T fatiguées
« Le fait qu’une majorité de patients ne réagissent pas à ce traitement reste un défi à relever. Une des explications est que les lymphocytes infiltrant la tumeur et luttant contre les cellules cancéreuses, s’épuisent et finissent par être incapables de contrôler la progression des cellules cancéreuses. Dans le jargon scientifique, nous disons que les cellules T dysfonctionnent. Elles ne répondent pas ou plus à l’immunothérapie », indique Li Tang.
Les chercheurs ont alors ajouté une protéine fabriquée artificiellement, nommée protéine de fusion interleukin-10-Fc, au traitement d’immunothérapie. « L'interleukin-10 peut soit stimuler, soit désactiver notre système immunitaire. Cependant, nous ne savions que peu de choses sur la manière exacte dont elle interagit avec les cellules T qui infiltrent la tumeur jusqu’à nos expériences, précise Yuqing Xie, assistant-doctorant. Mais, il semble que nous avons trouvé un nouveau mécanisme qui pourrait revitaliser les cellules T épuisées. » Les tests ont révélé que l’interleukin-10-Fc agit comme un booster d’énergie, permettant aux lymphocytes d’être réactivés et de continuer à combattre la tumeur. « En utilisant cette protéine, nous avons pu reprogrammer le métabolisme des cellules T et améliorer leurs rôles destructeurs de cancer ainsi que leur développement », ajoute Yugang Guo, doctorant.
 Un cartoon illustrant les cellules T épuisées puis boostées par l'Interleukin-10-Fc ©
Un cartoon illustrant les cellules T épuisées puis boostées par l'Interleukin-10-Fc ©
LBI/Xiaomeng Hu/2021 EPFL
Plus de 90 % de guérison
Cette nouvelle immunothérapie a été testée sur des souris, et les résultats sont sans appel : plus de 90 % d’entre elles ont vaincu le cancer. « L’interleukin-10-Fc s’avère sûre et très efficace. Cette protéine entre en synergie avec l’immunothérapie par transfert de cellules T adoptives, comme la thérapie CAR-T, ou les inhibiteurs de points de contrôle immunitaires, conduisant à l’éradication de tumeurs et à des guérisons durables chez une majorité de souris soignées. Notre méthode semble améliorer considérablement les immunothérapies existantes contre les tumeurs solides, connues pour être difficiles à guérir », se réjouit Li Tang. D’après ces premiers tests, aucun effet secondaire n’a été observé, ce qui rend prometteurs les futurs essais cliniques. Les chercheurs Yugang Guo, Yuqing Xie et Li Tang ont déposé des brevets internationaux pour cette nouvelle thérapie et vont prochainement procéder à des essais cliniques sur des patients.
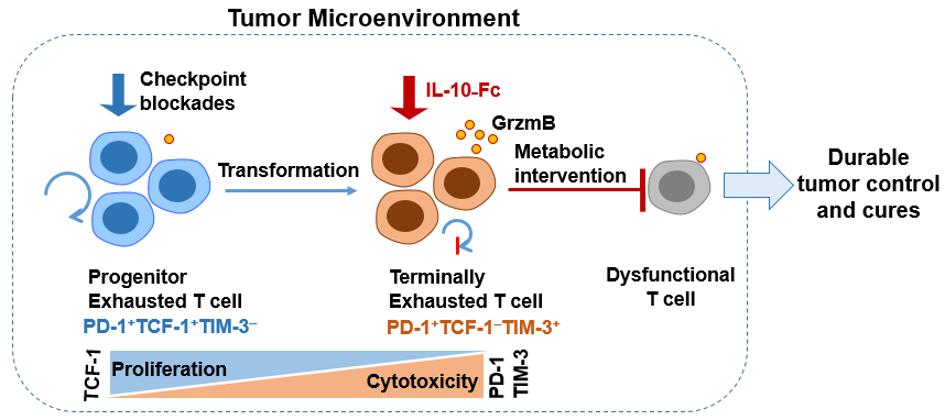
Contrairement aux blocages des points de contrôle immunitaires, l'interleukine-10-Fc (IL-10-Fc) permet d'étendre directement les cellules T épuisées en phase terminale et de promouvoir leur fonction effectrice par une reprogrammation métabolique, ce qui entraîne un contrôle durable des tumeurs. © LBI/Yugang Guo/2021 EPFL
Percée du goulot d'étranglement
Parmi les cellules T infiltrant les tumeurs, un sous-ensemble appelé cellules T CD8+ en phase terminale, ne répond pas à la plupart des immunothérapies existantes, y compris les blocages des points de contrôle immunitaires. Il est connu pour être extrêmement difficile à réactiver. La recherche du professeur Li Tang montre que la reprogrammation métabolique de ces cellules par le biais d'une molécule, appelée transporteur de pyruvate mitochondrial, est suffisante pour restaurer la fonctionnalité des cellules T CD8+ épuisées en phase terminale dans la lutte contre le cancer. Cette découverte jette les bases d'une identification plus poussée des stimulations métaboliques nécessaires pour revigorer les cellules T CD8+ en phase terminale, un goulot d'étranglement majeur dans le domaine de l'immunothérapie du cancer.
